我校贾大团队连发两篇高水平论文揭示先天性糖基化疾病的发病机制并提出相关治疗策略
先天性糖基化疾病(CDG)是临床上常见的、由于蛋白质或脂类糖基化缺乏引起的遗传疾病。先天性糖基化疾病可累及神经、消化、造血、生殖系统等多个脏器,从而引起多种临床表现。迄今为止,已有100多个基因的突变可能导致先天性糖基化疾病。遗憾的是,绝大多数还没有治疗方法。甘露糖代谢在人类发育和疾病中十分重要。GDP-甘露糖焦磷酸化酶B(GMPPB)与GDP-甘露糖焦磷酸化酶A(GMPPA)一起催化GDP-甘露糖的形成,GDP-甘露糖作为糖供体参与四种糖基化途径。GMPPA与GMPPB的突变都会导致先天性糖基化疾病,其特征包括神经功能缺损和肌肉营养不良。目前,GMPPA与GMPPB突变引起相关疾病的发病机制尚不清楚,也缺乏有效的治疗策略。值得一提的是,GMPPB的突变导致病人体内GDP-甘露糖水平的下降,而GMPPA的突变引起GDP-甘露糖水平的上升,揭示保持适当的GDP-甘露糖的水平对人类的正常生理过程至关重要。然而,目前仍不清楚细胞是如何维持GDP-甘露糖稳态的。
近日,我校华西第二医院、生物治疗国家重点实验室贾大教授团队及合作者,在Nature子刊《Nature Structural Molecular Biology》(通讯作者贾大、北京大学生命科学院高宁)、《Molecular Biomedicine》(通讯作者贾大、华西第二医院涂英凤、蔡晓唐)连发2篇高水平论文,阐明了GMPPA与GMPPB协同维持体内GDP-甘露糖水平的分子机制,揭示了GMPPA与GMPPB 突变导致先天性糖基化疾病的原因,并探讨了GMPPA与GMPPB先天性糖基化疾病的可能治疗办法。该研究为先天性糖基化相关疾病在临床上的诊疗提供了重要参考依据。
发表在《Molecular Biomedicine》的研究报道了一名来华西第二医院诊治的1岁男孩患者。患者早在1个月大时就出现上肢和下肢肌肉无力,肌肉活检显示为慢性肌病。脑核磁共振成像结果显示患者小脑发育异常。利用外显子组测序技术,作者发现患者GMPPB基因含有两个复合杂合子突变 (c.332T>G (p.Val111Gly) 和 c.640G>A (p.Gly214Ser))。这些突变分别遗传自他的父母,但其父母并没有显示出明显的异常。
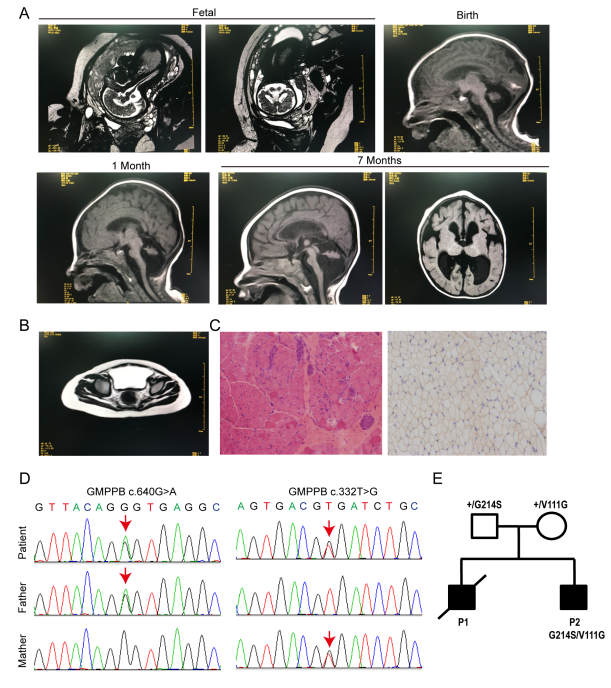
图1 临床样本数据与患者基因突变分析
作者开发了一种测定GMPPB酶活性的方法,发现V111G突变显著降低了GMPPB的酶活性;G214S突变不影响酶活性,但是影响其在细胞中的定位。作者还研究了17个已报导的GMPPB错义突变体,发现这些突变体不同程度地影响了GMPPB的酶活性。利用斑马鱼作为模型生物,作者发现GMPPB突变体的酶活性与斑马鱼的肌肉和神经元表型相关:酶活性越低,其对斑马鱼神经和肌肉的影响越严重。
发表在《Nature Structural Molecular Biology》的研究,作者解析了GMPPA和GMPPB复合物的冷冻电镜结构,并综合利用生化、细胞及斑马鱼模型揭示了GMPPA和GMPPB如何协作维持体内GDP-甘露糖的稳态。GMPPB亚基具有催化GDP-甘露糖生成的活性;GMPPA亚基本身不具有催化活性,但是可以和GDP-甘露糖结合。高浓度的GDP-甘露糖引起GMPPA构象发生变化,抑制GMPPB的活性。这些结果完美地解释了GMPPA和GMPPB的缺失如何不同地影响了GDP-甘露糖的水平。作者选择GMPPA和GMPPB的错义突变或致病突变进行验证,发现这些突变通过影响底物结合、酶的催化作用或蛋白质的稳定性来损害复合物的装配和酶催化活性,从而影响GDP-甘露糖的产生。
最后,作者通过利用模式动物斑马鱼分别建立GMPPA或GMPPB的敲降模型,发现GMPPB和GMPPA的敲降会使得斑马鱼轴突变短,肌纤维紊乱。这些表型缺陷可以被野生型的GMPPA或GMPPB回补,但是无法被来自于病人的致病突变体回补。此外,作者通过注射不同浓度的GDP-甘露糖,证明适当浓度的GDP-甘露糖可以挽救GMPPB缺失导致的表型缺陷;与GMPPB不同,不同浓度GDP-甘露糖的注射无法挽救GMPPA失导致的表型缺陷。
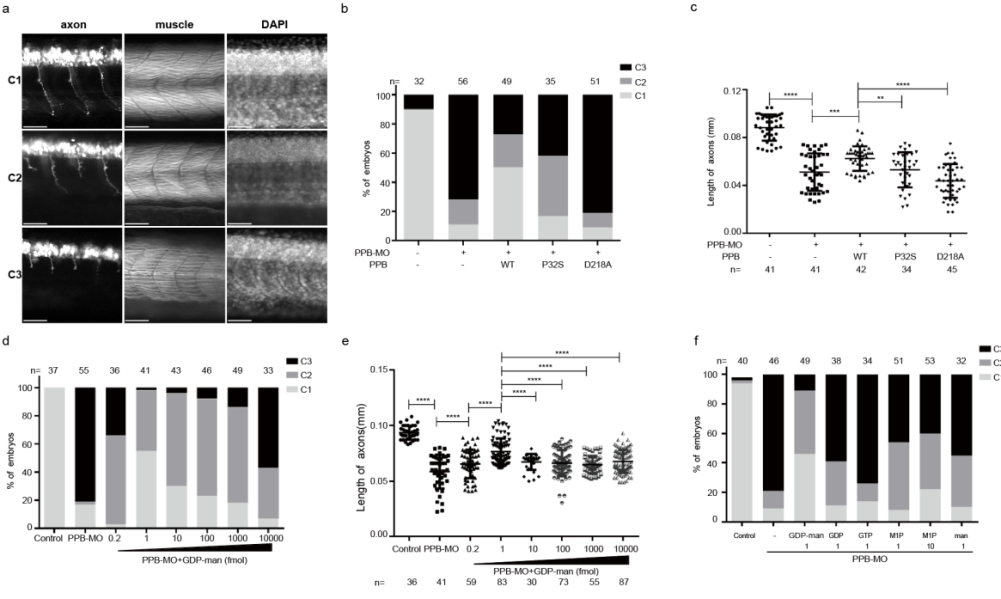
图2 补充GDP甘露糖可以挽救斑马鱼由于GMPPB表达下调导致的神经肌肉发育障碍的表型
在以往的研究中,科研人员付出了大量的心血去探究先天性糖基化疾病每种亚型的发病机制,以便针对性地开发治疗策略,取得了一定的成果。例如,产前补充甘露糖已被提出用来治疗PMM2缺陷的先天性糖基化疾病(PMM2-CDG)。这两项研究揭示了GMPPB的酶活性降低是GMPPB-CDG发生的一个重要原因,补充GDP甘露糖或其类似物可能是GMPPB-CDG的潜在治疗策略。与GMPPB相反,GMPPA的突变引起体内GDP-甘露糖水平的上升。GMPPB的抑制剂可能用来治疗GMPPA-CDG。该两项研究为先天性糖基化疾病在临床上的诊断,及开发治疗方案提供了重要依据。
贾大, 四川大学华西第二医院、生物治疗国家重点实验室教授,博士生导师,国家高层次青年专家。课题组综合利用细胞生物学、生物化学、蛋白质组学、模式动物 (斑马鱼与小鼠)等多种手段,来回答囊泡运输及相关疾病致病机制的问题,并探讨相关疾病的治疗方案。共发表SCI论文38 篇,被引用超过4000余次。自2015年10月加入四川大学,作为通讯作者或共同通讯作者在JCB、NSMB、 PNAS、Nature Communications、PLoS Biology、STTT、Molecular Biomedicine、JBC等期刊发表论文。2018年,课题组研究成果入选四川大学“十大基础科学进展”
【免责申明】本专题图片均来源于学校官网或互联网,若有侵权请联系400-0815-589删除。