MolecularCell刊发基础医学院孙书国团队研究成果
2月18日,我校同济基础医学院孙书国团队在Molecular Cell在线发表题为“Interferon-gammainduces tumor resistance to anti-PD-1 immunotherapy by promoting YAP phase separation”的文章。该研究发现在小鼠肺腺癌的遗传学模型和细胞移植瘤模型中,经抗PD-1治疗的肿瘤细胞中转录激活因子YAP被激活并且发生了核内相分离。进一步研究发现YAP相分离颗粒通过招募转录因子、组蛋白修饰酶和Mediator复合体形成转录活性中心促进YAP靶基因的高效表达,最终引起免疫治疗耐受。该研究还深入解析了YAP的相分离机制,发现其超螺旋结构域介导的疏水相互作用是其相分离发生的关键,为临床上解决免疫治疗的适应性耐药提供了理论支撑。
肺癌是癌症的头号杀手,居于各类癌症死亡率之首。我国由于控烟形势严峻和空气污染,肺癌的发病率一直居高不下,每年约有70万人死于肺癌。在肺癌的治疗方面,除了传统的手术、放疗和化疗以外,近年来的靶向和免疫治疗收到了不错的效果,但耐药情况十分普遍。例如抗PD-1的抗体类药物在黑色素瘤的治疗中表现良好,相较而言,在肺癌的治疗上效果要逊色一些。临床上常见的免疫治疗抵抗分为3种,原发性、适应性和获得性抵抗。其中,适应性抵抗表现为在治疗起始阶段存在疗效,但是一段时间后进入耐药。因此进一步理解适应性抵抗的机制对临床上更广泛地免疫检查点抑制剂的使用十分必要。
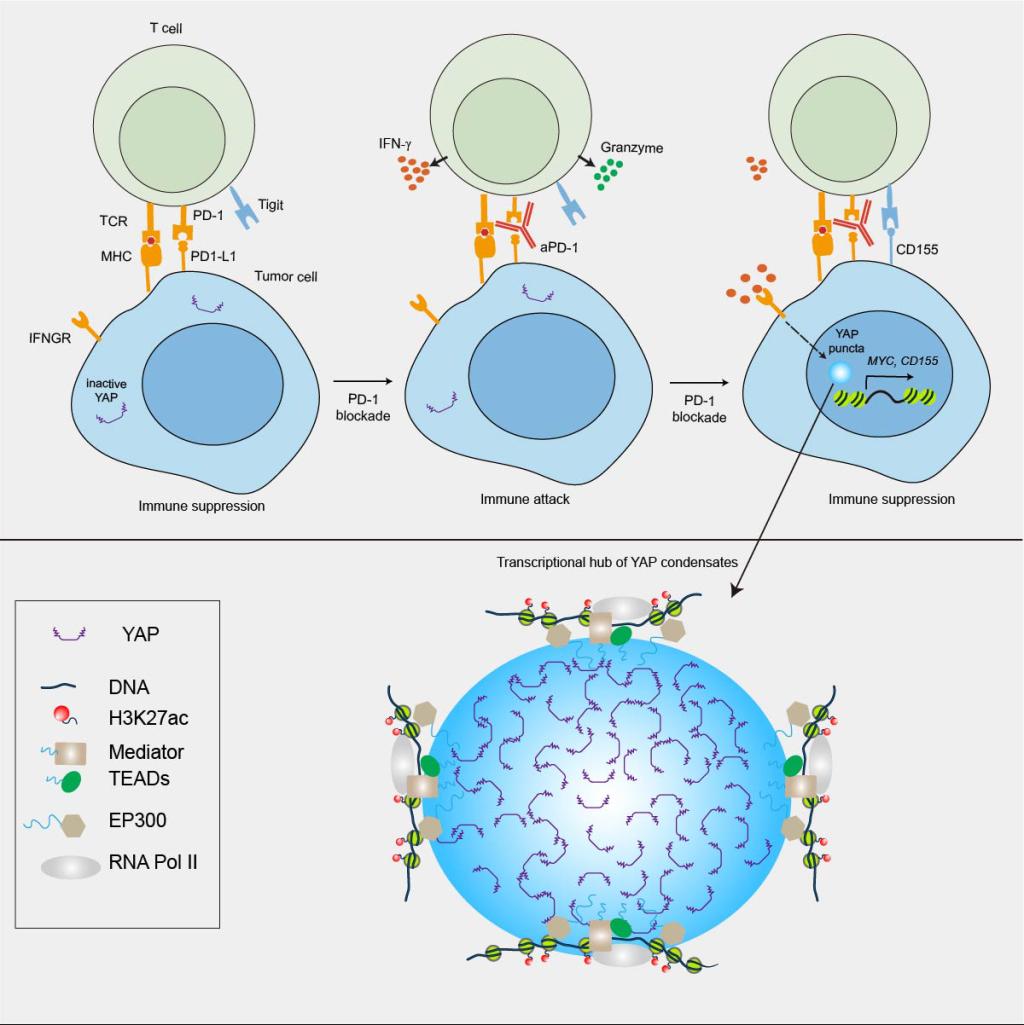
图为YAP的相分离在肿瘤免疫治疗中的功能模型
基础医学院博士后余满和博士研究生彭政鑫为共同第一作者,教授孙书国为通讯作者,基础医学院为第一完成单位,该研究的合作者包括基础医学院教授杨想平和李岩,该研究得到了国家自然科学基金、科技部重点研发计划和华科大高层次人才基金的大力支持。
【免责申明】本专题图片均来源于学校官网或互联网,若有侵权请联系400-0815-589删除。