华西医院生物国重、化工学院钮大文团队开展医工结合揭示非共价相互作用促进的1,2-cis-糖苷化反应策略

北京时间2022年4月11日晚23时,我校华西医院生物治疗国家重点实验室、化工学院钮大文教授团队与加州大学洛杉矶分校Houk团队合作在Nature Chemistry上发表了一篇题为“Halogen-bond-assisted radical activation of glycosyl donors enables mild and stereoconvergent 1,2-cis-glycosylation”的研究工作。我校为论文第一单位和通讯作者单位,钮大文为共同通讯作者。
糖类在免疫、细菌和病毒感染、肿瘤发生及迁移等几乎所有生理病理过程中都发挥着不可或缺的作用。人类重大疾病基本都与糖类化合物相关。现有上市小分子药物中有百余个属于糖类药物;许多活性天然产物也含有糖基侧链。糖基化修饰不但是蛋白质重要的翻译后修饰过程之一,同时也是改善蛋白/多肽药物稳定性的重要手段。因此,对糖的研究是化学、生命科学、医学、材料科学等各领域的重要分支。深入研究糖类化合物也是理解生命过程以及开发新型药物的重要平台。因此,开发简单、高效、高选择性的糖苷键构建方法具有重要价值。
在合成化学领域,糖苷键的构建已取得瞩目的成就和进展,但仍存在诸多挑战和困难。主要包括:a)糖基化供体多数存在稳定性差,制备困难等问题;b)目前多数糖基供体的活化需要在强酸或强路易斯酸添加下进行,限制了糖苷化反应的底物适用性;c)高立体选择性构建1,2-cis糖苷键仍较困难。
卤键/氢键协助的糖供体自由基活化策略实现1,2-顺式糖基化反应
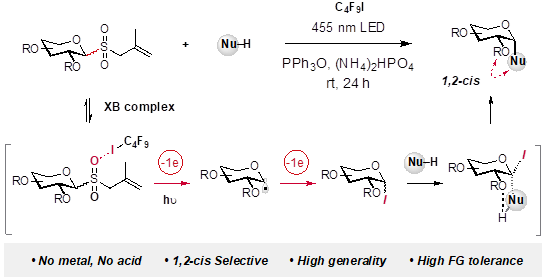
在前期研究工作中,钮大文课题组设计了一类烯丙基砜糖基供体,其具有制备简单、结构稳定、易于保存的优点。该课题组展示了此类糖基供体可以在温和条件下被激发产生糖自由基,并可应用于蛋白质和多肽的S-糖基化反应(JACS, 2021, 143, 11919)。在此工作基础上,该课题组设想可否将该糖基供体产生的糖自由基进一步氧化成碳正离子,进而被醇类捕获,实现氧苷化反应。在近期工作中,该团队实现了这一设想并开发了相应的糖苷化反应。不同于传统的酸促进的离子型糖苷化反应,这一新反应不使用金属、强(路易斯)酸、复杂催化剂或不稳定糖基供体。这种糖苷化反应展现了广泛的官能团耐受性、底物适用性以及立体选择性(Nature Chemistry, 2022, AOP)。
从机理角度而言,这一糖苷化反应的两个特征引起了该研究团队的兴趣。1,此反应需要在光照条件下进行,但不需要使用额外的光敏剂。2,此反应具有很好的1,2-顺式选择性。钮大文课题组与Houk团队合作,通过实验以及DFT计算深入探究这两个特征的本质原因。结果表明:烯丙基砜糖基供体与全氟碘代烷形成的卤键复合物可能直接吸收可见光,并引起C–I键均裂,从而产生关键的多氟碘代烷基自由基。该自由基进一步与烯丙基砜糖基供体结合反应,引起一系列后续键的重拍和断裂步骤产生糖自由基。糖自由基再被氧化成碘代糖并被进一步捕获生成氧苷。
该反应的高立体选择性同样意外。各种类型烯丙基砜糖基供体可以以立体汇聚方式构建具有挑战性的1,2-顺式糖苷。通过DFT计算、动力学实验、控制实验,该团队提出此反应的1,2-顺式立体选择性是通过糖环上C2-氧原子与亲核试剂间形成氢键相互作用介导实现。团队提出,简单的C2-烷氧基即可以作为构建1,2-顺式-糖苷键的有效导向基团。因此,该反应同时利用了卤键和氢键两种非共价相互作用。
研究团队展示了这一新糖苷化反应的适用性。各种醇类、苯酚类、羧酸类和酰胺类亲核试剂均可以使用此方法进行糖基化反应。十余种糖基供体也可以参与到此反应中。团队进一步展示了使用该方法合成复杂糖缀合物的潜力。
总之,钮大文/Houk团队报道了一种利用非共价相互作用在温和条件下构建1,2-顺式糖苷键的方法。该方法使用了钮大文课题组前期开发的糖基供体。通过实验和理论计算,该团队对此反应的机理提出了假设。该方法有很高的底物适用性,有望成为制备糖类化合物的有效工具。
该工作在国家自然基金委优青项目和面上项目、四川大学华西医院1•3•5计划项目以及美国NSF项目的经费支持下完成。实验分析测试部分在四川大学分析测试中心帮助下完成。
【免责申明】本专题图片均来源于学校官网或互联网,若有侵权请联系400-0815-589删除。