基础医学院党永军团队在靶向调控蛋白翻译起始研究领域取得新进展
近日,基础医学院生化与分子生物学系代谢分子医学教育部重点实验室党永军团队在靶向真核翻译起始因子eIF4AI抑制剂作用机制研究方面取得重要进展,发现了天然产物血根碱抑制eIF4AI酶活,并揭示了该抑制剂的分子机制。相关研究成果于8月8日以《Targeting the N-terminus of eIF4AI for Inhibition of its Catalytic Recycling》为题在线发表于Cell子刊Cell Chemical Biology杂志。蛋白翻译是中心法则的最后一环,是控制细胞内蛋白质稳态的关键生命过程。蛋白翻译起始(Translation initiation)是整个翻译过程最关键的限速步骤。翻译过程的失调与神经发育类疾病以及恶性肿瘤等多种疾病密切相关。真核蛋白翻译起始因子eIF4A(eukaryotic translation initiation factor 4A)是最早被发现的DEAD盒(DEAD-box)RNA解旋酶(RNA helicase)超家族的成员,它可与eIF4E、eIF4G等形成eIF4F翻译起始复合体,是调控帽子结构依赖的蛋白翻译起始的关键分子,也是目前肿瘤干预的新的分子靶标。党永军研究员早期利用抗肿瘤活性海洋天然产物pateamine A,通过化学生物学手段鉴定了eIF4A是其体内的分子靶标,首次证明了该蛋白在生物体内的可靶性(Mol Cell, 2005),并利用pateamine A揭示了一种新的stress granule形成机制以及蛋白翻译起始也与相变(phase transition)有关(JBC,2006)。以此为基础,采用分子动力学模拟与生物学实验相结合的手段,解析了蛋白翻译起始因子eIF4A的ATP水解酶和RNA解旋酶偶联机制,首次揭示了eIF4AI两个保守结构域之间的柔性Linker区域,在调控ATP水解与RNA解旋偶联中扮演的重要作用。鉴于DEAD盒家族成员的高度保守性,这一发现对进一步研究其它DEAD盒家族蛋白质的功能也具有重要指导意义(Nucleic Acids Res,2015)。另外,首次报道去泛素化酶USP9X可以与蛋白翻译起始复合物相互作用,通过去泛素化eIF4AI从而调控了整体翻译的效率,并改变了一系列的对翻译调控敏感的癌基因。此项研究不仅发现了一种新的蛋白翻译调控机制,也拓展了蛋白翻译起始的调节方式和新的调控靶标(Nucleic Acids Res,2018)。在这些研究的基础上,该团队通过筛选小分子化合物文库发现了天然产物血根碱在体内外均可以抑制eIF4AI ATP水解酶和RNA解旋酶的活性,也具有抑制帽子结构依赖的蛋白翻译的活性,并首次解析了eIF4A与小分子抑制剂的超高分辨率共晶结构,同时通过单分子荧光共振技术揭示了其作用机制。以上工作为后续的蛋白翻译机制研究以及该天然产物的结构改造奠定了基础,也为从小分子出发,发现作用分子靶标,探讨靶标的功能以及后续新的活性分子的发现提供了很好的研究模式。
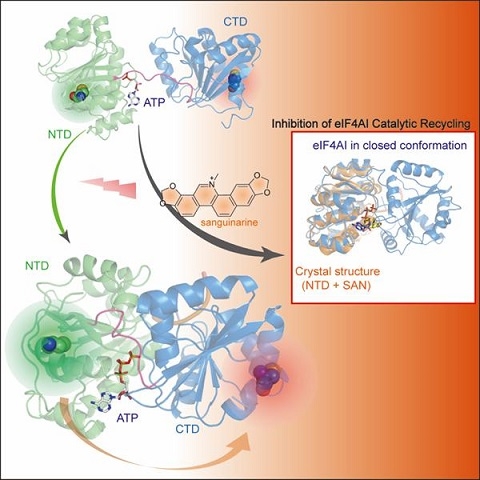
血根碱通过与N-末端结合来干扰eIF4AI的催化循环示意图此项研究得到了国家自然科学基金和上海市人才发展基金资助。复旦大学基础医学院党永军研究员、化学系刘建伟研究员和生命科学院丁滪副教授为论文的共同通讯作者。蒋晨晓博士、汤叶根博士和丁露露博士为论文的共同第一作者。中科院上海药物所罗成研究员以及东华大学曹张军副教授等团队也参与了此项工作。
【免责申明】本专题图片均来源于学校官网或互联网,若有侵权请联系400-0815-589删除。