我校华西医院生物治疗国家重点实验室董浩浩研究员团队在NatureStructural&MolecularBiology上发表文章――解析蛋白质机器LolCDE的结构及功能,揭示革兰氏阴性菌外膜脂蛋白的识别及转运机制
近日,我校华西医院生物治疗国家重点实验室董浩浩研究员团队在国际期刊 Nature Structural & Molecular Biology上发表了题为 “Structural basis for bacterial lipoprotein relocation by the transporter LolCDE” 的研究论文。该研究工作由董浩浩研究员团队,浙江大学医学院冷冻电镜中心主任张兴教授团队,及英国东安格利亚大学医学院董长江教授团队合作完成。我校生物治疗国家重点实验室副教授唐晓迪博士、浙江大学冷冻电镜中心负责人常圣海博士、我校实验室助理人员张可及博士研究生罗庆华为并列第一作者。该研究得到了四川大学魏霞蔚教授、朱晓峰教授和武汉大学张郑宇研究员的大力支持。我校生物治疗国家重点实验室/国家老年疾病临床医学研究中心为该论文第一作者单位和通讯作者单位。

该研究解析了多重耐药细菌—革兰氏阴性菌用于转运外膜脂蛋白成分的蛋白质机器LolCDE
(apo),及其与底物脂蛋白、ADP、ATP同构抑制剂AMP-PNP和周质蛋白LolA相结合的6个高分辨率冷冻电镜结构,展示了其转运功能中4个中间态构象。同时,该研究进一步通过生化功能试验揭示其识别及转运脂蛋白的功能位点,为以此蛋白质机器为靶点设计新型抗菌药物提供了重要的科学依据。
革兰氏阴性菌以铜绿假单胞菌、肠杆菌、鲍曼不动杆菌为代表是临床常见,也是耐药菌最为集中的一类致病菌,其特有的外膜结构是防止抗生素进入细胞最重要的保护屏障。位于革兰氏阴性菌外膜的脂蛋白是一类重要的功能蛋白,参与众多外膜组分(包括脂多糖、磷脂、外膜β-桶蛋白和脂蛋白等)的运输及组装,以维持细菌外膜脂质双分子层的不对称性、完整性及各项生理功能,是整个外膜形成的核心,对于耐药菌的生长和存活起到了重要的作用。脂蛋白定位机器 (localization of lipoprotein) LolCDEAB 负责将几十种外膜脂蛋白从细菌内膜转运到外膜中。外膜脂蛋白在细胞内膜中的错误定位可导致细菌死亡,因此理解外膜脂蛋白的定位机制,发现其定位蛋白质机器的药物靶点,对于开发潜在新型抗生素具有重要意义。
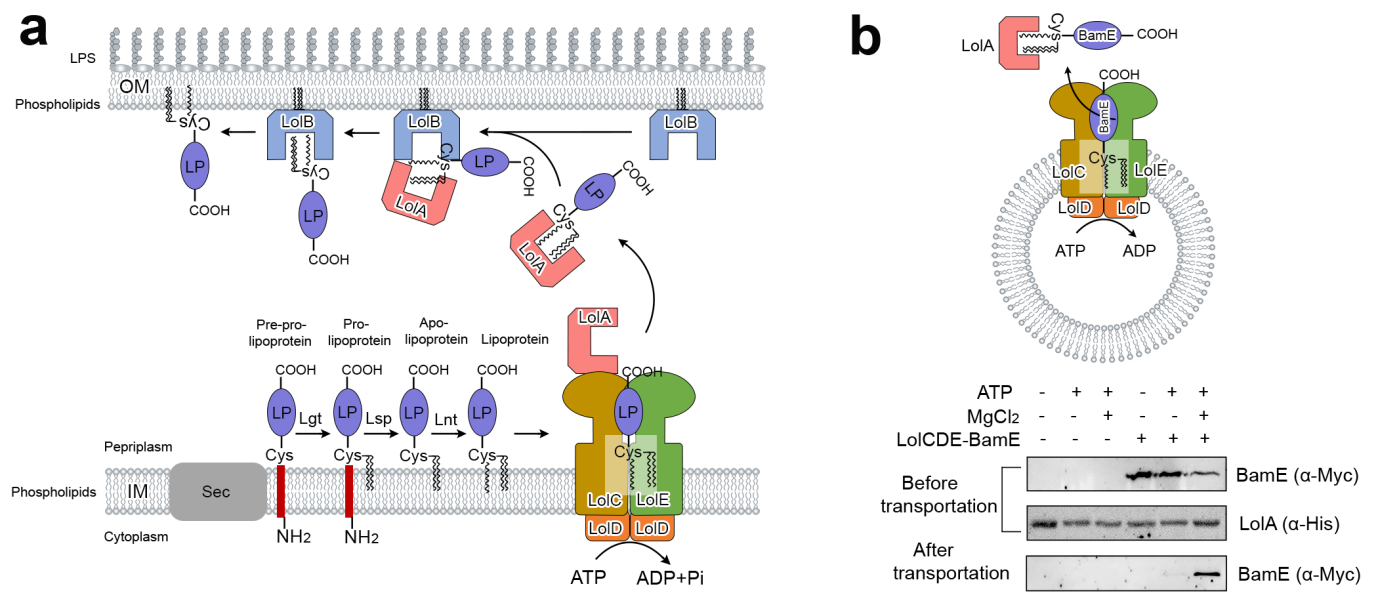
革兰氏阴性菌的脂蛋白(包括内膜脂蛋白和外膜脂蛋白)在细菌胞内合成后处于细菌内膜的周质一侧,蛋白质机器LolCDE通过识别脂蛋白N-端的转运信号来分类是否是外膜脂蛋白,从而将目标底物由内膜提取并转运给周质中的传递蛋白LolA。该研究团队通过单颗粒冷冻电镜技术首次解析了负责该步骤的LolCDE的分子结构,揭示了蛋白质复合体各功能域与配体之间的分子细节和相互作用关系。通过捕获处于不同转运阶段中LolCDE的不同功能构象,包括空腔态(apo-state)、底物结合态(lipoprotein-binding
state)、ATP结合态(ATP-bound dimerized state)和与LolA相结合的底物释放前态(LolA-bound pre-release
state),展示出一套完整的脂蛋白转运的机制变化。
该研究的发现证实了LolCDE不同于其他细菌ABC转运体的对称变构机制,其跨膜亚基LolC和LolE在参与脂蛋白转运中具有不同的功能。LolE负责识别和定位脂蛋白,而LolC充当一个机械杠杆,传导ATP结合及水解前后NBD(ATP结合域 nucleotide-binding domains)到PD(周质域 periplasmic domains)的构象变化,通过协调蛋白质机器的各个功能域以进行脂蛋白的提取和转运。LolCDE与其他VII型ABC 转运体的结构同源性表明,该机械转导机制可能在此类转运蛋白家族中通用。总之,该研究通过揭露的蛋白质机器LolCDE与底物脂蛋白所结合的分子细节,开展了定点单突变和体外构建蛋白磷脂囊泡的模拟转运实验,发现了多个通过阻碍其转运功能可抑制细菌生长的功能位点,可作为研发抑制剂的药物靶点。该研究对于理解其他VII型ABC转运体的作用机制以及促进对多重耐药革兰氏阴性菌治疗的药物开发具有重要意义。
【免责申明】本专题图片均来源于学校官网或互联网,若有侵权请联系400-0815-589删除。