药学院饶燏团队及合作者在CDK2降解剂设计与应用方面取得突破
清华新闻网3月9日电 近日,清华大学药学院饶燏团队与浙江大学药学院应美丹团队合作,发现了一类新型CDK2选择性降解剂,实现了高效而低毒的AML细胞分化治疗效果,为AML治疗提供一种潜在的分化治疗方案。
周期蛋白依赖性激酶(CDK)是一组丝氨酸/苏氨酸蛋白激酶,具有较短的N末端(β-折叠)和较长的C末端(a-螺旋)。CDK通过与相应周期蛋白cyclin和周期蛋白依赖性激酶激活激酶(CAK)产生相互作用,在细胞周期的各个阶段发挥作用,参与细胞的生长、分化、增殖等生理过程,介导细胞周期的有序进行。CDK2是CDK家族的一员,广泛表达于哺乳动物细胞内,但其功能可被其它CDK家族成员代偿,因此对于大多数正常细胞和组织CDK2是非必须的。然而,在肿瘤发生、细胞分化、减数分裂和听力损伤修复等过程中CDK2却发挥着重要功能,近年来的研究发现CDK2敲降可诱导AML细胞产生分化。然而,传统的小分子抑制剂难以实现选择性的CDK2抑制,也不能消除CDK2的非酶活功能,药效不足且副作用严重。基因编辑技术则在应用效率和临床使用中存在诸多不足。虽然认为CDK2是良好的药靶,但现有工具难以对其实现高效的选择性调控。
PROTAC技术是一种利用小分子诱导靶蛋白泛素化,利用泛素化蛋白酶体途径实现靶向蛋白敲降的技术。PROTAC由靶蛋白配体、E3泛素连接酶配体和连接链Linker构成(图1)。该小分子可诱导该靶蛋白与E3泛素连接酶相互作用,从而实现靶蛋白的非天然泛素化,被泛素化的靶蛋白进一步被蛋白酶体识别而降解。PROTAC技术实现的降解不仅依赖于小分子的亲和力,也需要靶蛋白和E3泛素连接酶在空间上的特异性相互作用。因此,在合理设计和充分优化的条件下,PROTAC技术与传统小分子抑制剂相比较在理论上可实现更好的选择性。目前高选择性CDK2敲降PROTAC分子还未有文献报道。
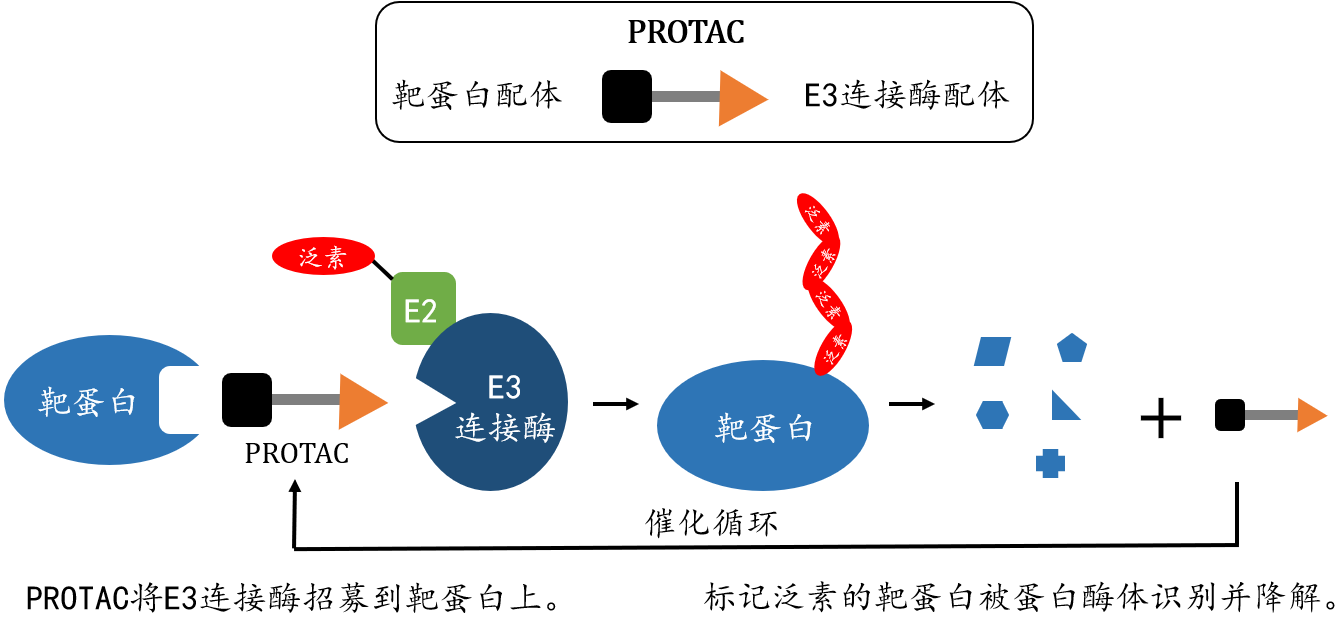
图1. PROTAC技术的原理
如何实现CDK2的选择性敲降是这篇工作中作者解决的核心技术问题。亲和力水平是PROTAC发挥功能的基础,为保持与CDK2蛋白的亲和力,研究者对分子结构进行了充分的模拟,与CDK2存在重要相互作用的结构单元需保留而暴露于溶剂区的位点则用于Linker延伸,这样的设计可最大程度的保留与CDK2的亲和力水平,而降低与非靶向蛋白的亲和力。历经多轮迭代设计与分子结构优化,最终基于筛选出的配体,成功发展出以J2为配体的CDK2选择性降解剂CPS2(图2)。

图2.CDK2降解剂的设计、优化和活性
研究者开发的这类新型CDK2降解剂有以下特点。适用范围广:在这篇工作中,作者尝试测试了10余种细胞系,CPS2均可在纳摩尔浓度下实现对CDK2有效敲降。选择性佳:较小分子抑制剂,CPS2的选择性有显著提升。作者运用了激酶组学、激酶活性测试、蛋白质组学和western blot等试验,证明了当使用CPS2处理细胞时,在可观测的蛋白范围内,CDK2的降解最为显著,而对其它蛋白没有显著影响(图3)。
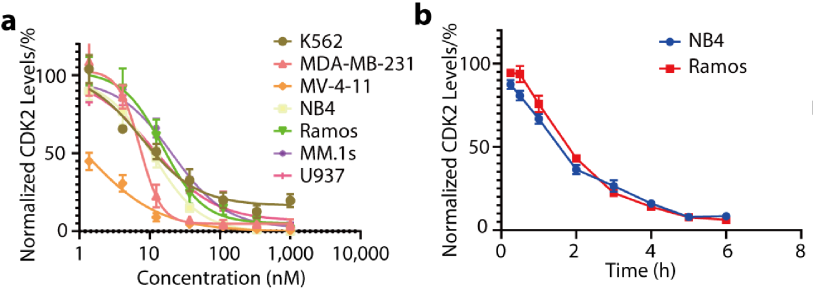
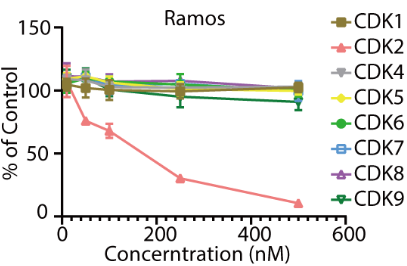
图3. CPS2在多种细胞系内诱导CDK2的高效选择性降解
CPS2解决了CDK2抑制剂选择性的问题,对正常细胞(Beas2b、293T细胞系)的毒性较小,但CPS2可通过抑制肿瘤细胞增殖的方式产生抗肿瘤效果(图4)。作者也进行了在动物体内急毒实验,结果表明CPS2的安全性远高于其母核抑制剂J2(图5)。
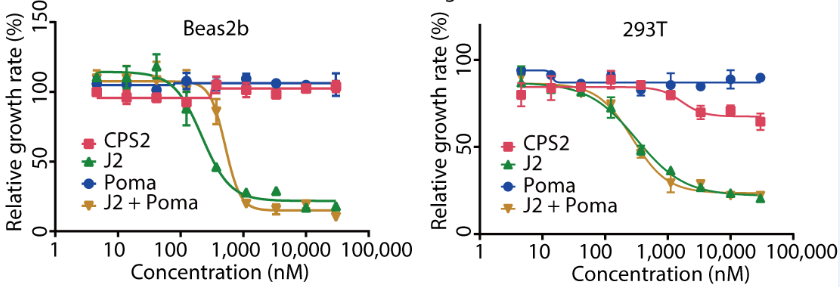
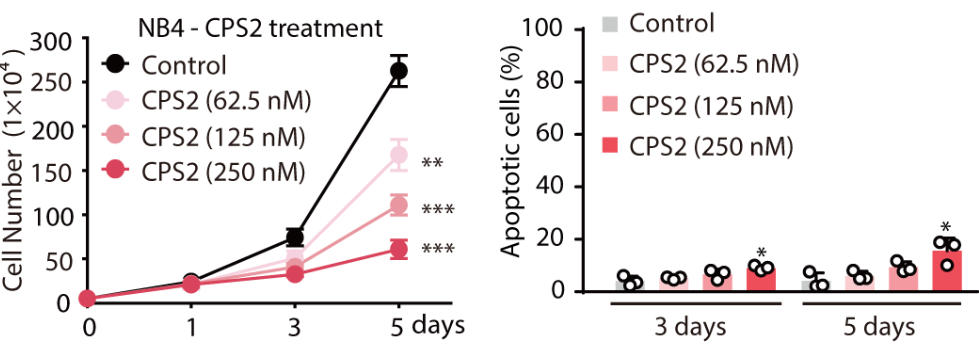
图4. CPS2对正常细胞影响较小,但可阻滞肿瘤细胞快速增殖
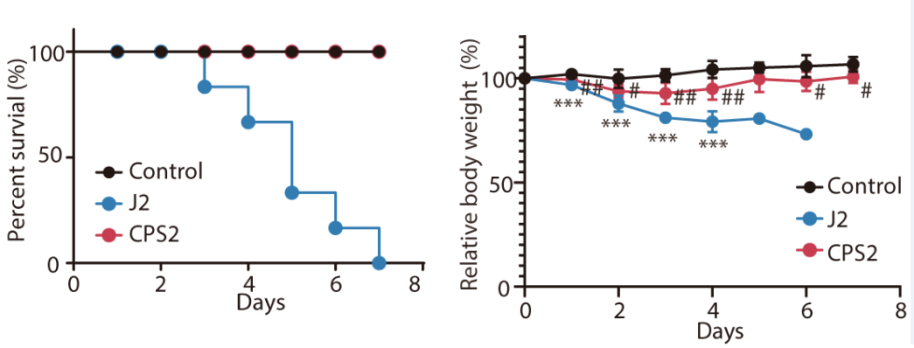
图5. CPS2的体内安全性较高
研究者将CPS2进一步应用于AML分化治疗中。在CPS2处理下,AML细胞的分化指标显著升高,细胞形态更成熟(图6)。同时,作者进行了多组Rescue实验,证明了CPS2通过引起细胞内CDK2的降解执行分化诱导功能。为充分论证CPS2作为CDK2选择性降解剂在AML临床治疗上的重要意义,研究者采集了多株AML病人原代细胞,并加入CPS2进行处理。结果表明,原代细胞在药物的处理下也可产生明显分化,充分证明了CPS2的潜在临床应用意义。
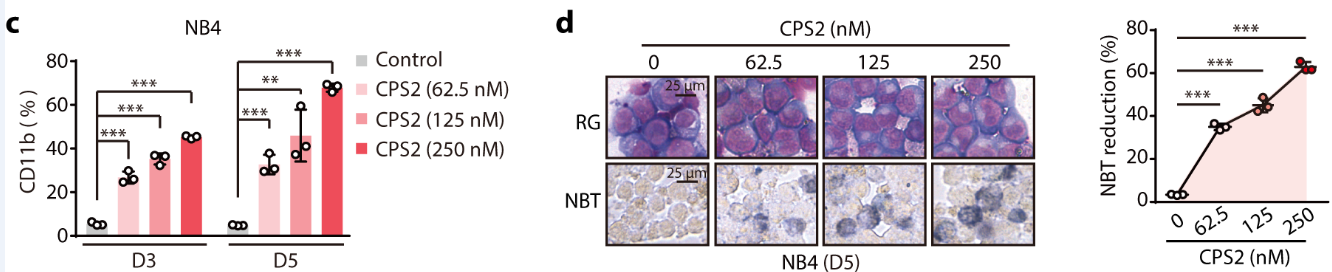
图6. CPS2处理下,AML细胞产生明显分化
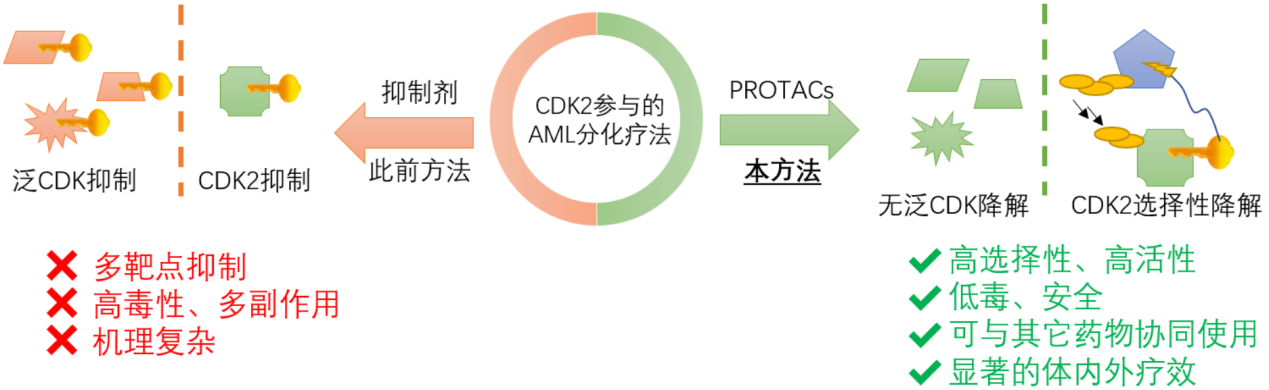
图7. CPS2的功能特色
在该工作中,研究者开发了一类CDK2选择性降解剂,并初步研究了该分子的安全性和有效性。研究者将这项新的发现应用于AML分化治疗领域,为AML治疗提供了一种潜在的高效、低毒的新型治疗方案(图7)。除AML治疗外,该类降解剂或可在CDK2相关的其它疾病治疗领域也发挥重要功能。
以上研究于3月5日在《自然·化学生物学》(Nature Chemical Biology)期刊上发表题为《首个用于AML分化治疗的CDK2选择性降解剂的发现》(“Discovery of a first-in-class CDK2 selective degrader for AML differentiation therapy”)的研究论文。
清华大学博士生王立国、浙江大学博士后邵雪晶、清华大学博士生钟天白、清华大学博士生吴越和浙江大学博士生许爱笑为该工作共同第一作者,清华大学饶燏教授和浙江大学应美丹教授为共同通讯作者。该研究得到了清华大学吴畏教授、陶庆华教授、李海涛教授、中国科学院北京基因组研究所王前飞教授的大力帮助。该研究得到了中国国家自然科学基金会、国家重大科技专项“重大新药开发”和国家重点研发计划的大力支持。
【免责申明】本专题图片均来源于学校官网或互联网,若有侵权请联系400-0815-589删除。