西安交大科研人员在细胞力学信号转导机制研究方面取得新进展
生物体内的细胞始终受到多种形式的力学刺激。例如,在心脏舒张、收缩过程中,心肌细胞受到周期性的拉应变刺激。此外,不同的组织内,细胞周围基质的刚度也有所不同(从脑组织的102Pa到骨组织的109Pa)。细胞膜上的整合素是一种力学感受蛋白,其一端黏附在细胞周围基质上,另一端黏附在细胞骨架(细胞内部蛋白质纤维构成的网络结构系统)上,形成了力学传导网络。细胞骨架的收缩可以通过整合素,以张力形式作用于细胞周围基质,并将力学刺激信号转导为生化信号,进而激活细胞内一系列应答反应,影响细胞的迁移、增殖和分化等正常生理行为,以及癌症及组织纤维化等病理过程。然而细胞是如何通过整合素依赖的力敏感过程将细胞外力学刺激信号转导为细胞内生化信号及其分子机制是当前力学生物学领域迫切需要解决的科学问题之一。因此,深入研究不同基质刚度作用下细胞膜上整合素介导的力-化转导机制,有助于帮助人们理解细胞如何通过细胞黏附响应外界力学信号,并为治疗相关疾病提供相应的药物靶点。
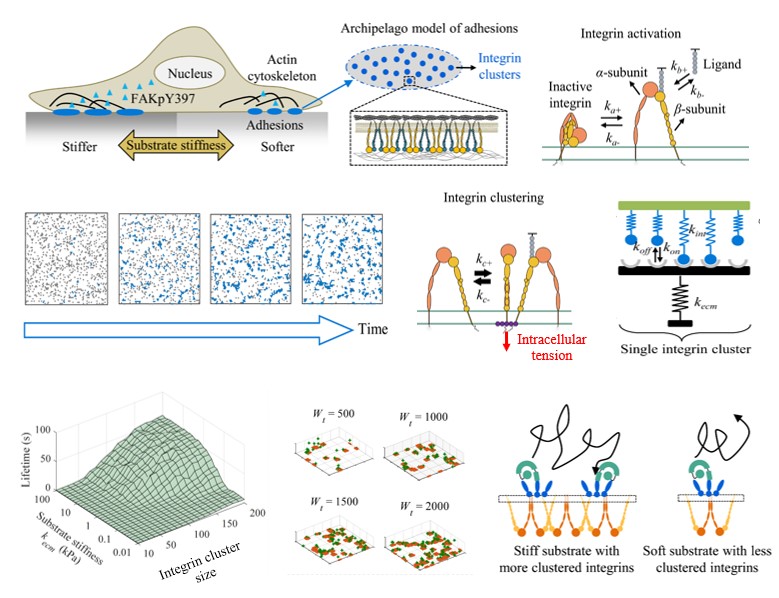
西安交大生命学院仿生工程与生物力学研究所研究人员通过耦合整合素分子的激活/聚集动力学过程、整合素团簇分子键的断裂解离及其内部黏着斑激酶磷酸化这三个过程,建立了整合素团簇(integrin
cluster)依赖的细胞力学信号转导模型,刻画了不同的细胞周围基质刚度(力学信号)与不同种类细胞黏着斑激酶(FAKY397)磷酸化水平(生化信号)的量化关系,并得到了细胞生物学实验结果的验证。研究人员发现,使细胞产生不同的FAKY397磷酸化水平的主要影响因素是细胞骨架牵张力作用下整合素团簇的生存时间(lifetime
of
cluster),而不是FAK分子微观动力学速率的改变,进而从细胞骨架牵张力作用下整合素团簇生存时间的角度揭示了基质刚度依赖的FAKY397磷酸化水平差异的分子机制。研究成果也为进一步理解“应力-生长”理论提供了重要依据。由于整合素的异常表达与疾病的发生与发展密切相关,诸如β3整合素的高表达促进乳腺癌的转移,β1整合素在心肌纤维化的过程中含量逐步升高,因此该研究为进一步开发针对以整合素为靶向分子的药物提供了坚实的理论基础。
该成果以“整合素团簇通过FAKY397磷酸化调控细胞力敏感行为(Nanoscale Integrin Cluster Dynamics Controls Cellular Mechanosensing via FAKY397 Phosphorylation)”为题,在Science Advances上以封面论文形式发表,并被特别推荐在其主页上。该论文第一作者是生命学院博士生程波、口腔医院博士生万婉婷,通讯作者是林敏教授。西安交大为该论文的第一作者和唯一通讯作者单位。同时,该研究得到了卢天健教授、徐峰教授、华盛顿大学圣路易斯分校Guy Genin教授、加利福尼亚大学伯克利分校Mohammad R. K. Mofrad教授等的大力协助。研究工作获得了国家自然科学基金、陕西省青年拔尖人才支持计划,陕西省基金的资助。
论文链接为:https://advances.sciencemag.org/content/6/10/eaax1909
【免责申明】本专题图片均来源于学校官网或互联网,若有侵权请联系400-0815-589删除。