复旦大学丁琛团队/侯英勇团队、上海交通大学赵健元团队联合通过蛋白质组学特征揭示胃癌对化疗和靶向治疗反应的新策略
胃癌是最常见的消化道恶性肿瘤之一,也是世界范围内第二癌症致死原因。目前,手术、化疗和放疗是胃癌的主要治疗策略。然而,胃癌一线治疗方案,包括三药联合DOS化疗(多西他赛、奥沙利铂和爱斯万)和两药联合XELOX化疗(卡培他滨和奥沙利铂),其客观缓解率仅30%左右。随之,抗HER2靶向联合治疗与单独化疗相比可改善患者的中位生存,客观缓解率可提高至60%,被批准作为HER2阳性胃癌患者的一线治疗方案;然而,抗HER2靶向联合治疗的患者选择偏向性和预防耐药策略仍有待证实。尽管在治疗方面取得了很大进展,但仍缺乏预测胃癌治疗反应的全面分子图谱。
基于团队先前于北京蛋白质组研究中心(BPRC)展开的胃癌相关研究中,收集了84例弥漫型胃癌患者的手术样本,并对其进行了蛋白质组学分析。根据蛋白质组学分子特征,将弥漫型胃癌队列分为三种亚型 (PX1–3),其中亚型3 (PX3) 预后最差,且对化疗耐药,这提示化疗反应与患者的蛋白质组特征相关。基于这一发现,本研究试图建立蛋白质组学特征和临床结果之间的综合联系。
基于此,复旦大学人类表型组研究院/生命科学学院丁琛教授团队、复旦大学附属中山医院侯英勇教授团队和上海交通大学医学院附属新华医院赵健元教授团队联合对接受一线治疗 (包括DOS治疗,XELOX治疗及抗HER2靶向联合治疗) 的206例中国胃癌患者的治疗前样本进行了蛋白质组学定量分析 (图1),相关研究成果以“蛋白质组学特征揭示了胃癌对化疗和靶向治疗反应的治疗新策略(Proteomic Characterization of Gastric Cancer Response to Chemo and Targeted therapies Reveals New Therapeutic Strategies)”为题,于北京时间2022年9月29日在线发表于最新一期《自然·通讯》(Nature Communications)杂志上。
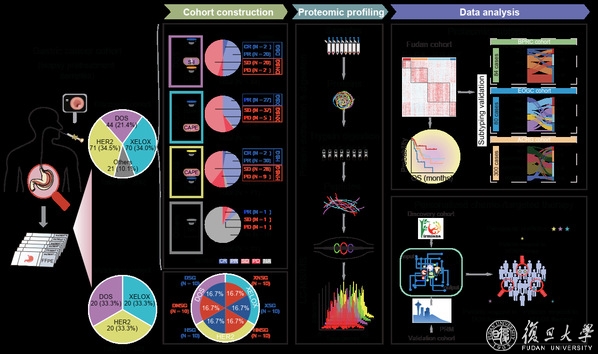
图1 蛋白质组学工作流程
本研究绘制了胃癌不同治疗反应相关的全面蛋白质表达图谱,确定了与治疗反应及预后显著相关的分子分型(G-I-G-IV)。G-I亚型以内吞为主要特征,G-II亚型以糖酵解、泛酸盐和辅酶A生物合成为主要特征,G-III亚型以溶酶体为主要特征,G-IV亚型以细胞外基质受体相互作用和凝血补体级联反应为主要特征。结合治疗反应,从G-I亚型到G-IV亚型,化疗和靶向治疗反应呈现出逐渐的耐药现象: 敏感患者比例从60%急剧下降到20%;相反,非敏感患者的比例从40%增加到80%。其中,G-IV亚型预后最差(图2 a-d)。此外,在其他独立胃癌队列中验证了该分子分型。本研究发现微卫星不稳定的胃癌患者对DOS治疗反应敏感,但对XELOX治疗反应不敏感。生物信息学分析显示,与非敏感组相比,DOS敏感组的T细胞受体信号转导活跃,CD8+T中央记忆细胞积聚,而XELOX治疗则相反。进一步比较分析显示,TCR信号转导水平高的胃癌患者不太可能从XELOX治疗中获益,而可以从联合抗HER2靶向治疗中获益;而ECM及其下游PI3K-AKT通路的激活会削弱HRE2治疗的抗肿瘤作用。接下来,本研究进行了进一步的体外验证实验, 证实了抗HER2靶向治疗与XELOX或PI3K-AKT抑制剂联合的协同效应。

图2 分子分型
此外,本研究开发了高精度的预测化疗和靶向治疗反应的预后模型,并通过PRM靶向蛋白质组学技术在新的独立验证队列中得到验证(图3)。最后,本研究验证了CTSE通过微管稳定作用作为多西紫杉醇化疗敏感性的细胞内在增强剂,而TKTL1通过诱导异常染色体分离起到衰减器的作用。
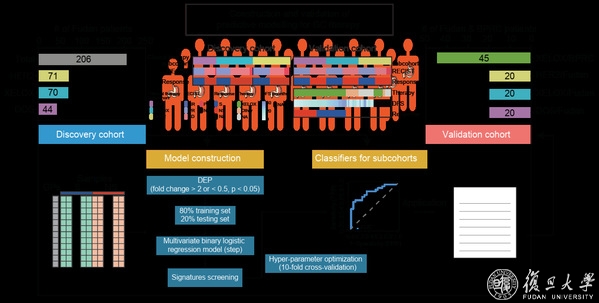
图3 预测模型
这一成果绘制了胃癌化疗和靶向治疗的蛋白质表达图谱,确定了与治疗反应及预后显著相关的分子分型,探究了不同化疗及靶向治疗反应的敏感耐受机制,构建了高精度的预测治疗反应的模型,在一定程度上促进了个体化化疗/靶向治疗的发展,将我们推向蛋白质组学驱动的精准医疗时代。
复旦大学人类表型组研究院李艳博士为本文第一作者,王冰博士、马发含博士、复旦大学附属中山医院徐晨博士、复旦大学生命科学学院徐富江博士为本文共同第一作者,复旦大学人类表型组研究院/生命科学学院
【免责申明】本专题图片均来源于学校官网或互联网,若有侵权请联系400-0815-589删除。