【科技自立自强】西安交大科研人员在《血液》杂志以封面文章发表血管炎症机制的突破研究成果
炎症反应是机体对于各种感染的自身防御机制,当病菌侵入人体体内时,血液中部分白细胞粘附于激活的毛细血管内皮细胞,通过变形穿过内皮间隙及血管壁,进入组织间隙,并集中到病菌入侵部位,将病菌包围﹑吞噬。白细胞游出血管(extravasation)是炎症反应最重要的特征,构成了血管炎症反应的主要防御环节。尽管在白细胞游出过程中,白细胞及血管内皮细胞均暴露于血液剪切力之中,但人们对此过程中涉及的力学机制尚缺乏研究。此外,白细胞在跨血管转移过程中会激活内皮细胞,引起钙内流,但过去近20年人们一直没有找到相关的离子通道或分子机制。
近日,西安交通大学医学部王胜鹏教授联合西安交大第一附院医院袁祖贻教授及德国马普所(Max-Planck-Institute)Stefan Offermanns院士团队在血液领域顶刊《血液》(Blood)杂志以封面文章形式发表了题为《白细胞渗出过程必需内皮压电型机械敏感离子通道组件1的参与》(Mechanosensation by endothelial PIEZO1 is required for leukocyte diapedesis) ”文章,报道了白细胞在跨越血管转移过程中,受到血流剪切应力的干预,引起血管内皮细胞膜张力升高,该机械力被Piezo1离子通道感知,引起内钙升高,从而激活内皮细胞,导致内皮细胞收缩及屏障开放,最终诱导白细胞完成转移。

为了探究血流剪切力对白细胞游出血管的作用及影响,研究团队运用离体剪切力模拟结合siRNA筛选技术系统筛选了内皮细胞上可能影响白细胞转移(trans-migration)的基因。研究团队发现,低剪切力对于白细胞转移有明显的促进作用,更重要的是缺失机械力敏感离子通道Piezo1的内皮细胞对白细胞的转移能力明显下降。同时,在白细胞转移过程中及剪切力的共同作用下,内皮细胞会产生强烈的钙信号,但缺失Piezo1后,该钙信号及其激活的下游信号几乎完全被抑制,这些结果提示Piezo1是白细胞激活内皮细胞,介导白细胞转运的关键基因。
研究者进一步采用内皮细胞特异性Piezo1敲除小鼠,通过巴豆油,白细胞介素IL-1及肿瘤坏死因子TNF-α等在小鼠体内建立多种炎症模型,利用血管三维成像分析技术发现,野生型小鼠在炎症刺激后有大量的白细胞从血管内转移至血管外组织中。而在内皮Piezo1敲除小鼠中,超过60%的白细胞仍然在炎症刺激后被限制在血管管腔内,不能完成正常的跨越血管转移。进一步,研究者通过GFP荧光标记小鼠血管内皮,利用双光子技术实现在体血管成像,在此基础上对白细胞在微血管中的活动进行了实时观察,结果发现在内皮Piezo1敲除血管里,白细胞在血管内壁上附着,滑行及粘附等行为均未见异常,但是白细胞的跨血管转移比正常小鼠减少了60%左右。基于上述现象,研究者提出Piezo1是血管内皮细胞介导白细胞转移,完成血管炎症反应的关键机制。
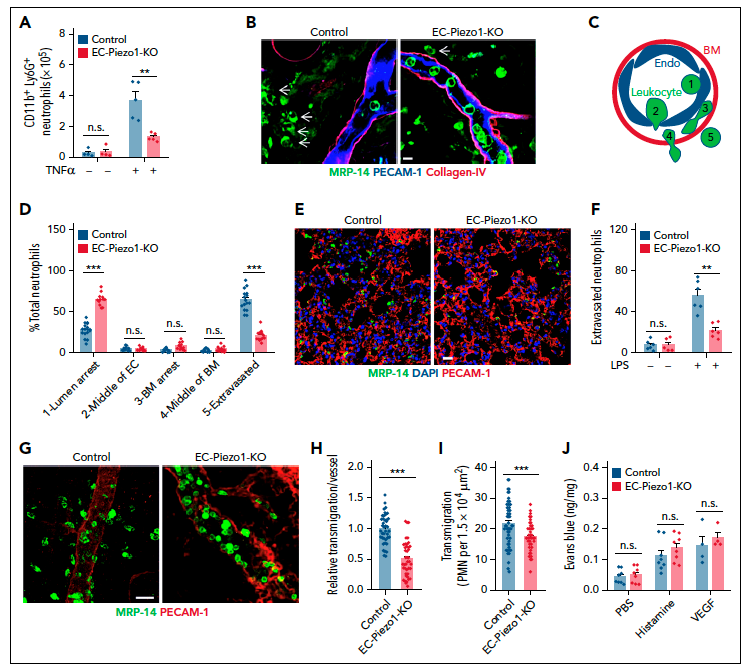
Piezo1是诺奖获得者Arderm Potapotian实验室发现的一种新型的机械力敏感离子通道,在心肌细胞、血管平滑肌细胞、骨骼干细胞及脂肪细胞等发挥力学感知作用。研究者团队前期也证实Piezo1是血管内皮细胞感知血流剪切力的关键受体, 为了进一步从力学角度探究Piezo1介导白细胞转移的分子机制,团队运用新型细胞膜张力荧光探针FliptR及MSS biosensor 探针,并结合FLIM荧光寿命成像及FRET技术,记录了白细胞在转移过程中对内皮细胞膜产生的力学影响,通过力学成像,研究者发现在静止状态下白细胞与内皮细胞接触仅造成内皮细胞膜张力的微弱升高,但如果在白细胞跨内皮细胞转移时加入流体剪切力,会造成内皮细胞膜张力的显著升高,从而激活细胞膜上力学受体Piezo1,导致外钙内流,进而激活Src, PYK2,MLC等一系列细胞内信号并导致VE-cadherin内吞,最终引起内皮细胞收缩及内皮屏障开放,从而介导白细胞跨越内皮转移至血管外。
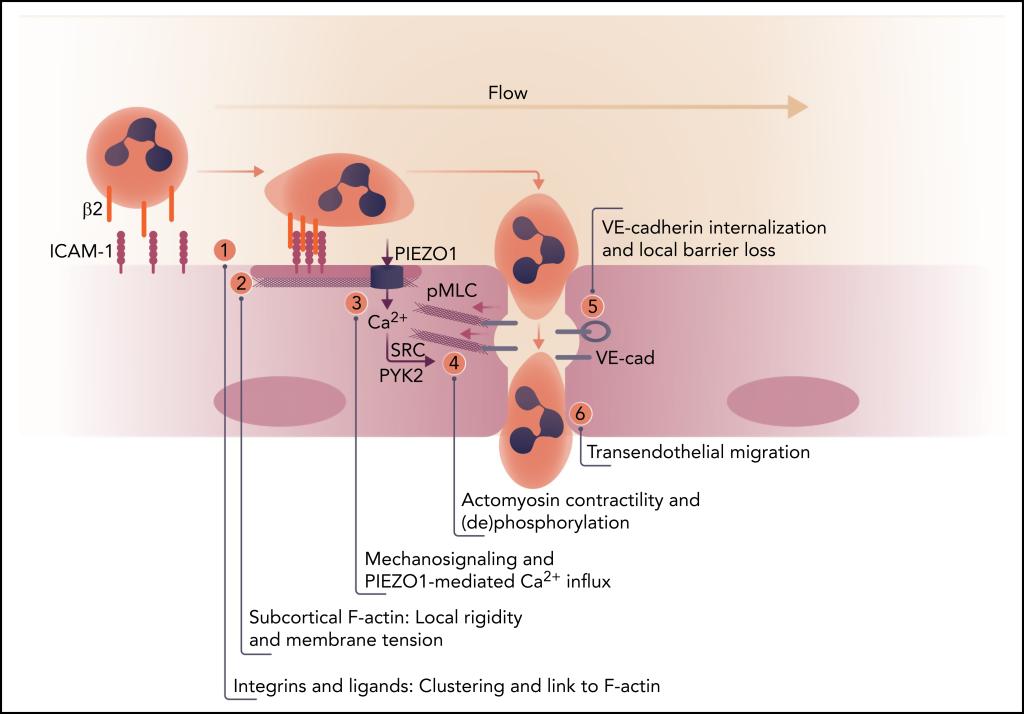
Blood杂志同期刊发了领域权威学者Peter L. Hordijk的专栏述评。Hordijk教授认为本工作解决了领域近20年亟待解决的一个关键问题:发现了Piezo1是白细胞激活内皮细胞、激发内皮细胞钙信号的关键离子通道,为白细胞的跨血管转移揭示了全新的力学机制。本项工作创新性地从生物力学角度揭示了血管炎症反应的关键力学机制,被Blood选为封面文章,入选Medscape当月推荐文章。该工作得到西交大一附院袁祖贻教授指导,生命学院王昌河团队的技术支撑,西安交通大学为该论文的第一和通讯单位。

近年来,在西安交大医学部基础医学院、心血管研究中心及第一附属医院等平台支持下,王胜鹏团队在血管及代谢疾病的力学调控研究取得系列进展,通过与袁祖贻、王昌河、Stefan Offermanns等团队多年合作,揭示了血管对血流剪切力的多个重要感知受体Gq/11、 P2Y2及Piezo1等,阐明了高血压、动脉粥样硬化的力学调控机制 ,并从力学视角揭示了肥胖等代谢疾病的发病机制。
【免责申明】本专题图片均来源于学校官网或互联网,若有侵权请联系400-0815-589删除。