南开科研团队揭示ATG9A泛素化修饰调控应激状态下高尔基体动态的机制
南开科研团队揭示ATG9A泛素化修饰调控应激状态下高尔基体动态的机制高尔基体是真核细胞内负责蛋白修饰、物质分选与运输的重要细胞器,高尔基体有规律的形态变化对于高尔基体功能维持、细胞周期调控、细胞极性的建立等有着极其重要的作用,高尔基体结构解聚、发生片段化就是最显著的变化之一。不可逆的高尔基体片段化也是帕金森综合征和阿尔兹海默症等神经退行性疾病的临床特征。但目前对于外界压力应激下,高尔基体结构的动态调控机制和生理功能还是未知的。

今年8月16日,南开大学生命科学学院/药物化学生物学国家重点实验室/细胞应答交叉科学中心的朱玉山教授、陈佺教授团队在Cell Reports上发表了题为“Nondegradable Ubiquitinated ATG9A Organizes Golgi Integrity and Dynamics Upon Stresses”的文章。该研究发现了在高温应激条件下,被泛素化修饰的ATG9A蛋白如何参与调控高尔基体动态变化及其功能的分子机制,拓展了ATG9A非经典自噬的新功能的认识。
ATG9A作为自噬相关蛋白中唯一一个多次跨膜蛋白,人们关注最多的是其在细胞自噬过程中发挥怎样的作用。朱玉山教授、陈佺教授课题组此前在Cell Research发表论文报道了激酶Src和激酶ULK1可以协调调控ATG9A磷酸化进而参与细胞自噬的膜泡运输的分选机制。越来越多的证据表明ATG9A通过非经典自噬的功能参与细胞功能调控,如参与细胞质膜损伤修复、脂类运输和细胞迁移等。高温高热对于生命个体来说是常见的生理和病理刺激,会导致细胞中的细胞器功能紊乱,如内质网和高尔基体片段化,线粒体膨大等,但是其中的分子机制并不清楚。
作者首先发现高温刺激不仅能引起高尔基体片段化,同时也发现包含ATG9A 的膜泡从反式高尔基体向胞浆分散运输。通过利用ATG9A敲除的细胞系,并结合免疫荧光技术、透射电镜,发现敲除ATG9A后能够明显抑制高温引起的高尔基体的片段化现象,而重新回补表达野生型ATG9A后,该现象又会得到恢复。表明ATG9A在高温诱导的高尔基体片段化过程中发挥非常重要的作用。机制分析发现在高温条件下E3泛素连接酶MARCH9能够使ATG9A发生K63位泛素化修饰,ATG9A进而与维持高尔基体片层结构的蛋白GRASP55互作,并抑制GRASP55的寡聚化,抑制了GRASP55连接高尔基体片层的作用,最终引起高尔基体片段化。通过功能分析发现高尔基体片段化实际是一种高尔基体压力应激响应方式,通过形态的改变而使影响高尔基体的基本功能,包括抑制对蛋白质的糖基化修饰作用、影响蛋白质的分选过程。
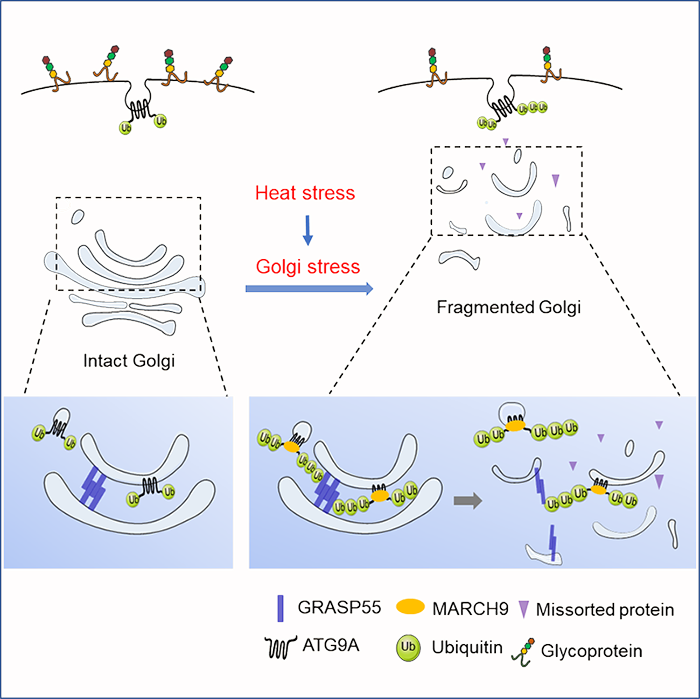
图:MARCH9泛素化修饰ATG9A调控应激下的高尔基的结构与功能
综上所述,该研究发现了 ATG9A 的泛素化修饰水平变化调控高尔基体片段化的过程。不仅解释了高温影响高尔基体形态结构的具体机制,还发现了 ATG9A非自噬的新功能。为研究压力应激条件下高尔基体的功能变化,并将高尔基体动态调控机制和ATG9A的功能应用于神经退行性等疾病的治疗提供了理论参考。
南开大学生命科学学院博士研究生罗倩为本文的第一作者,朱玉山教授和陈佺教授为共同通讯作者,南开大学物理学院潘雷霆教授团队在超分辨显微镜分析ATG9A与GRASP55定位提供了技术支持,该项目研究得到科技部和国家自然基金委资金的资助。
【免责申明】本专题图片均来源于学校官网或互联网,若有侵权请联系400-0815-589删除。