药学院王戈林和唐叶峰团队研发具有神经保护作用的NAD生物合成酶小分子激动剂
近日,清华大学药学院王戈林和唐叶峰团队针对人口与健康领域的重大需求,瞄准NAD代谢调控和神经退行等衰老相关疾病这一新的科学前沿热点,通过高通量药物筛选和基于靶点结构的理性药物设计,获得了靶向NAD生物合成限速酶烟酰胺磷酸核糖基转移酶(NAMPT)的新型小分子激活剂(NATs),为开发治疗神经退行性疾病的创新药物奠定了基础。
随着全球人口老龄化程度加深,诸如阿尔兹海默氏症(AD)、帕金森氏症(PD)等渐进性神经退行性疾病,以及其他疾病和治疗引起的急性神经退行性疾病(如脑卒中、化疗和糖尿病诱导的外周神经病变等)的发病率呈不断上升趋势,成为主要的衰老相关疾病类型之一。目前的药物能减轻一些症状,但有效药物和治疗方法匮乏。任何一种药物如果能安全有效地阻止神经细胞的退行和死亡,将具有巨大的治疗意义和应用前景。
烟酰胺腺嘌呤双核苷酸(NAD)是在动植物体内广泛分布的重要代谢物,主要有两大功能:一是作为氧化还原载体参与体内能量代谢和其他代谢过程;二是作为一系列NAD消耗酶的底物,通过这些酶调控多种信号转导过程。机体必须通过NAD代谢这个非常动态的过程维持足够并恒定的NAD水平,以发挥正常功能。近年来,越来越多的证据显示NAD代谢处于神经退行的调控中心,其稳态的维持对神经健康至关重要。在神经退行性疾病动物模型中,提高NAD水平可以改善神经细胞健康、记忆和认知功能。目前,最常见的提高NAD水平的方法是补充NAD前体,如NR、NMN、NAM或NA,国际上有多个相关临床试验正在进行中,并且NMN和NR作为抗衰老保健品或食品已在市场上热销。与此不同的是,在本项研究中王戈林和唐叶峰研究团队另辟蹊径,从发展NAD合成关键酶的激活剂入手,通过增强体内NAD生物合成,达到对抗神经退行的目的。
该研究靶向NAD生物合成挽救途径的关键限速酶NAMPT。相对于酶抑制剂而言,酶激活剂的发现极具挑战性,因而已知的酶激活剂屈指可数。在本项研究中,王戈林课题组首先通过高通量筛选发现了NAMPT小分子激活剂NAT,并深入研究了NAT作用机制和细胞保护功能(图1)。研究人员首次解析了NAMPT与小分子激活剂的晶体结构,在原子水平上观察到激活剂NAT作用于NAMPT的催化口袋内部,通过与酶活性位点附近区域的相互作用,促进两个底物NAM和PRPP的缩合形成NMN,提高NAMPT的催化效应,从而显示出对酶的别构激活作用。在此基础上,唐叶峰课题组采用理性药物设计理念,结合靶点和小分子复合物晶体结构信息,对NAT进行了系统地改造和优化(图3),最终获得了活性显著提高的候选药物分子NAT-5r。最近该研究团队还在《欧洲药物化学》上发表研究论文,详细报道了关于NAMPT小分子激活剂NAT的结构优化过程和构效关系研究,进一步揭示了此类小分子对NAMPT激活作用的关键分子机制。研究表明,NATs可增强细胞内NAD合成,并诱导代谢和转录重编程。重要的是,NATs在化疗诱导的外周神经病变的动物模型中表现出了良好的神经保护作用(图4)。与NAD前体相比,NATs具有以下优点: 能有效提升细胞内NAD含量;具有较好的生物利用度;有更大的结构空间进行药物特性的优化,合成简单,成本低,有利于后期开展临床研究;NAMPT激活剂的作用也会在限速步骤受到调节,以满足不同生理条件下细胞的需求。综上所述,此研究工作为理解神经退行性疾病的发生和发展提供新的视角,并在理论上提供NAD代谢物在神经保护中发挥重要作用的概念验证,从而为神经退行性疾病药物研发提供了潜在的候选靶点和药物。
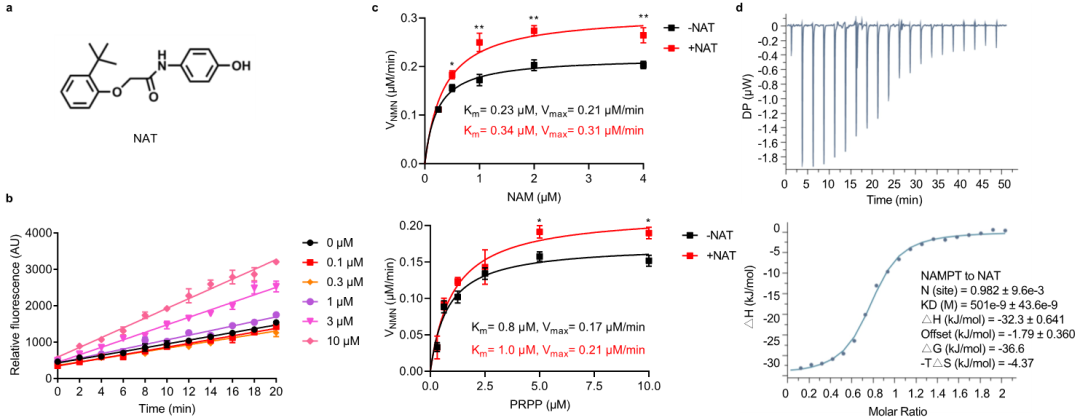
图1:通过高通量筛选发现新型NAMPT小分子激活剂NAT
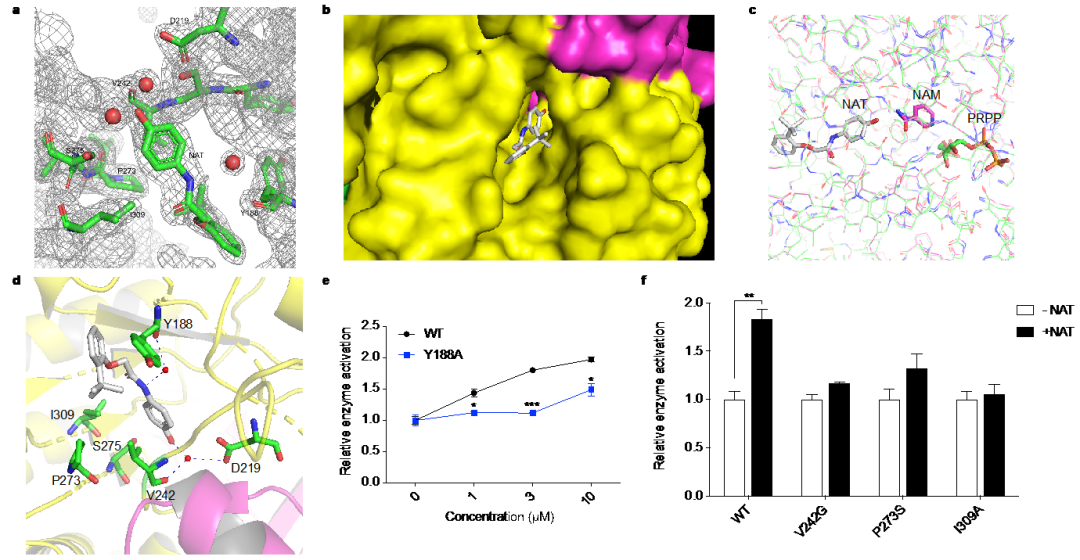
图2:通过NAT与NAMPT复合物晶体结构揭示小分子与靶点的作用模式

图3:针对先导化合物NAT进行结构改造和优化
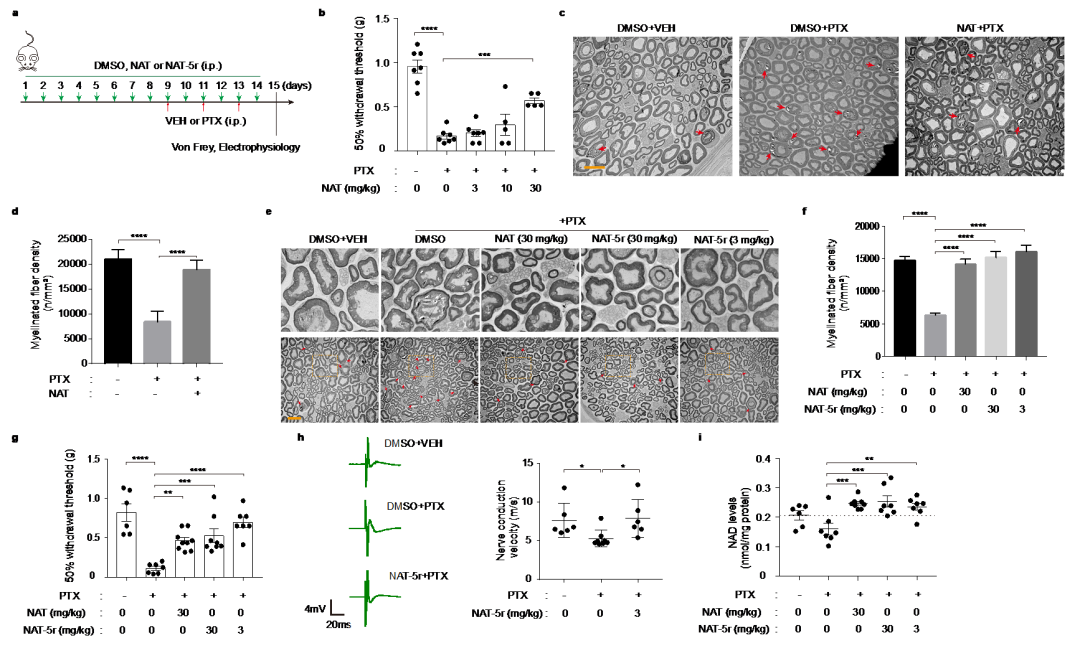
图4:NAT和NAT-5r在小鼠CIPN模型中的神经保护效果
上述研究在《细胞研究》(Cell Research)和《欧洲药物化学期刊》(European Journal of Medicinal Chemistry)期刊上相继发表标题为“烟酰胺磷酸核糖转移酶小分子激活剂的发现及其临床前神经保护活性研究”(Discovery of small-molecule activators of nicotinamidephosphoribosyltransferase(NAMPT) and their preclinical neuroprotective activity)和“烟酰胺磷酸核糖转移酶小分子激活剂的优化及其体内神经保护活性研究”(Optimization of NAMPT Activators to Achieve in vivo Neuroprotective Efficacy)的两篇研究论文。
清华大学药学院王戈林研究员和唐叶峰研究员为《细胞研究》论文共同通讯作者,清华大学药学院2018级联合培养博士研究生项目(PTN)博士研究生姚红、药学院2017级博士研究生刘明辉、王雷博、俎玉萌和药学院2016级联合培养博士研究生项目(PTN)博士研究生吴愁为该论文共同第一作者,清华大学药学院2016级本科生李晨雨、张若曦博士、2020级博士研究生陆海根、李菲菲博士、唐叶峰课题组实验技术人员席爽、2017级博士生陈双全、2018级本科生谷炫瑜,清华大学生命科学学院熊巍研究员、杨茂君教授、刘天涯博士,北京大学神经科学研究所邢国刚教授、蔡捷博士,北京理工大学智能机器人与系统高精尖创新中心汪世溶研究员,全球健康药物研发中心花兰博士为共同作者。清华大学药学技术中心、X射线晶体学平台、代谢与脂质组学平台、细胞影像平台,北京生命科学研究所测序平台提供了重要帮助。此项工作得到了国家自然科学基金委、清华-北大生命科学联合中心、清华大学高精尖结构生物学中心、清华大学-丰田联合研究基金专项项目经费的支持。
清华大学药学院唐叶峰研究员和王戈林研究员为《欧洲药物化学期刊》论文共同通讯作者,药学院2017级博士研究生王雷博、刘明辉、俎玉萌为共同第一作者,清华大学药学院2018级联合培养博士研究生项目(PTN)博士研究生姚红、2016级联合培养博士研究生项目(PTN)博士研究生吴愁、马伟男、张若曦博士、2020级博士研究生陆海根、唐叶峰课题组实验技术人员席爽、刘阳,全球健康药物研发中心花兰博士为共同作者。此项工作得到了国家自然科学基金、北京自然科学基金、清华-北大生命科学联合中心、清华大学高精尖结构生物学中心、清华大学-丰田联合研究基金专项项目经费的支持。
【免责申明】本专题图片均来源于学校官网或互联网,若有侵权请联系400-0815-589删除。