医学院模式动物研究所刘江怀/刘耕教授与合作团队创建新型肿瘤免疫重编基因环路
肿瘤的免疫治疗近来取得了巨大进展。进一步开发可定位于肿瘤病灶、而非全身性的免疫干预方法,将有望推动更高效低毒的免疫治疗。新兴的合成生物学为这种"智能化药物"的研发提供了可能,近年来基于基因组编辑技术的CRISPRa/i表观遗传调控工具的出现,更是为灵活实现肿瘤功能重编创造了条件。然而,目前许多识别肿瘤中高表达转录因子(transcription factor, TF)的合成基因环路缺乏严格的肿瘤特异性。因此,如何运用肿瘤中通常发生特异失活的转录因子(如p53)信息来精准门控肿瘤免疫重编是令人关注的问题。
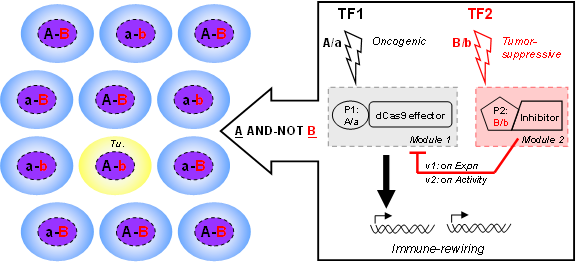
针对这个技术瓶颈,作者探索了一类新型基因线路 - 将一个致癌转录因子(TF1)驱动的CRISPRa效应器模块,与另一个响应p53信号(TF2)的负向开关相组装,从而依据TF1/TF2信号的AND-NOT逻辑而精确靶向肿瘤。这里,负向开关先后采用了抑制性sgRNA、或者是近来发现的抗CRISPR蛋白(anti-CRISPR protein, ACR)等两代架构。由于ACR强效的抑制能力,后一种架构显示出优越的特性,能在本底条件下感应p53的缺失而门控CRISPRa活性。这样优化后的AND-NOT逻辑环路可以由病毒载体递送至细胞,可特异在p53失活的肿瘤细胞中开启设定的免疫激活程序,并在小鼠体内产生治疗效果。整体来看,这种特异、灵活、有效的合成基因线路将为肿瘤相关的基础及应用研究提供新型工具。
2022年3月18日,南京大学医学院模式动物研究所、医药生物技术国家重点实验室成员团队协同上海科技大学、南京市鼓楼医院等合作单位在《自然-通讯》杂志(Nature Communications)发表了题为"Precise tumor immune rewiring via synthetic CRISPRa circuits gated by concurrent gain/loss of transcription factors"的研究论文。该研究首次构建了响应肿瘤细胞中转录因子信号同时获得和丢失的CRISPRa基因环路,一方面能精准识别肿瘤,另一方面能恰当启动抗肿瘤免疫,产生特异及有效的治疗效应。
该工作的第一作者(共同)为医学院模式所博士生王亚峰、张贵泉以及2019级毕业的孟庆洲博士;通讯作者分别为刘江怀、黄行许(上海科技大学)与刘耕教授。研究工作受到国家重点研发计划和国家自然科学基金等项目的资助。

【免责申明】本专题图片均来源于学校官网或互联网,若有侵权请联系400-0815-589删除。