华西医院生物国重室孙子宜、周小明团队揭示配体进入Sigma-1受体途径的分子机制
Sigma-1受体(σ1R)是一类非阿片类跨膜蛋白受体,主要位于细胞的内质网膜,在人体大部分器官和组织都有分布,介导细胞存活与多种生理活动。σ1R功能障碍与多种疾病如神经退行性疾病、癌症等相关。2016年发表的人源sigma-1受体(hσ1R)的晶体结构显示(图1左):σ1R结构采用同源三聚体形式,每个单体包含氨基端一次跨膜螺旋(α1)、中部含配体结合位点的β-桶体和羧基端贴近膜的V形双螺旋束(α4/α5)。之前认为配体进入σ1R的途径主要存在两种可能(图1右):第一种可能(PATH1)认为配体通过β-桶底部进入σ1R,这一过程涉及β-桶体的打开和重形成;而第二种可能(PATH2)认为配体通过α4和α5螺旋之间的开口进入σ1R的配体结合位点。由于缺乏明确的实验证据,σ1R的配体进入途径一直存在争议。
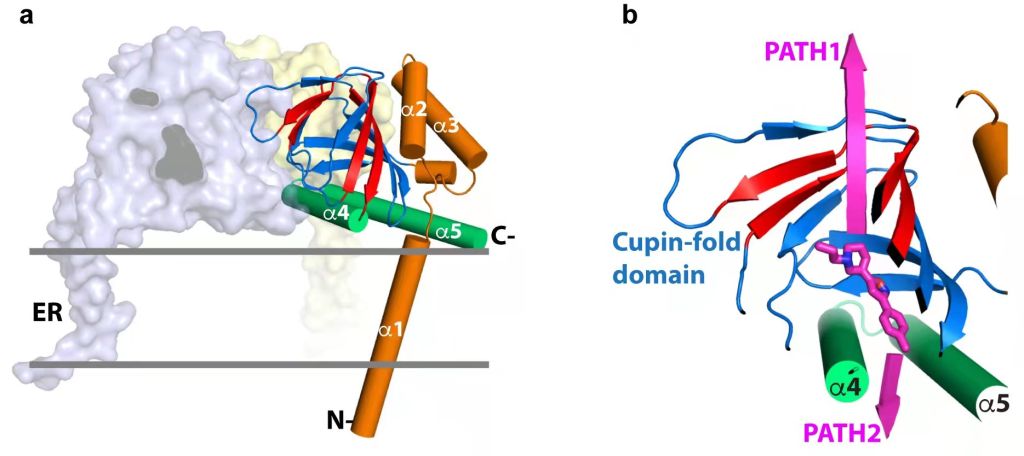
图1.σ1R的三维构象以及配体进出受体的两种可能途径。选自原文Figure 1。
2022年3月10日,四川大学华西医院生物治疗国家重点实验室/罕见病中心/中西医结合科孙子宜、周小明团队在Nature Communications上在线发表题为“An open-like conformation of the sigma-1 receptor reveals its ligand entry pathway”的研究成果,支持配体通过PATH2途径进入sigma-1受体。课题组孟富慧博士和博士研究生肖杨为共同第一作者,硕士研究生姬玉佳参与了该项研究。
该研究使用X-射线晶体衍射技术,首次解析了非洲爪蟾σ1R(xlσ1R)分别结合内源性配体(推测)和外源性配体(激动剂PRE-084、拮抗剂S1RA)的开放性/封闭式高精度三维结构。xlσ1R的封闭式结构与hσ1R结构类似,呈同源三聚体(图2左),但其晶体堆积方式以及配体浸泡xlσ1R晶体得到的受体-配体复合物结构显示,浸泡的配体无法通过PATH1进入xlσ1R。
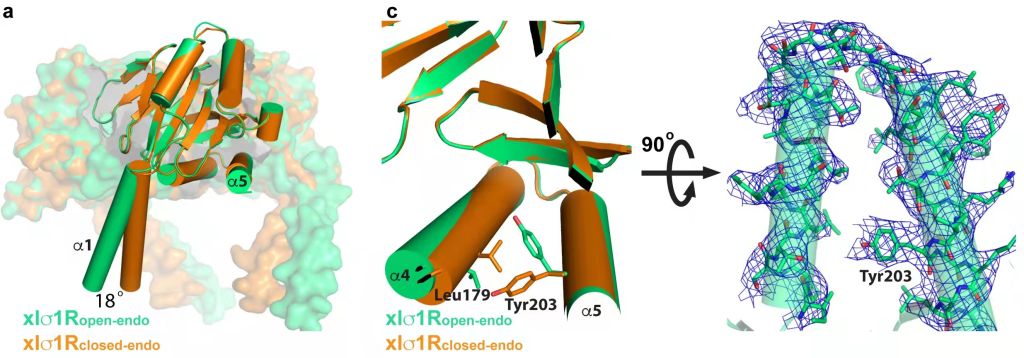
图2 σ1R的开放/封闭构象及α4/α5螺旋开口。选自原文Figure 3。
另一方面,xlσ1R开放性结构中α4螺旋发生旋转位移,α5螺旋上的203位酪氨酸侧链向内旋转,形成了一个允许配体通过的开口(图2右)。研究者设计二硫键突变体(L179C/Y203C)限制α4/α5螺旋的相对移动,并利用等温滴定量热法(ITC)测定配体与xlσ1R的结合参数,结果显示配体结合受限(图3)。另外,通过化学修饰增加开口处的空间位阻发现配体-受体结合受限程度与开口处空间阻碍程度相符。此结果为配体通过PATH2进入σ1R提供了有力证据。
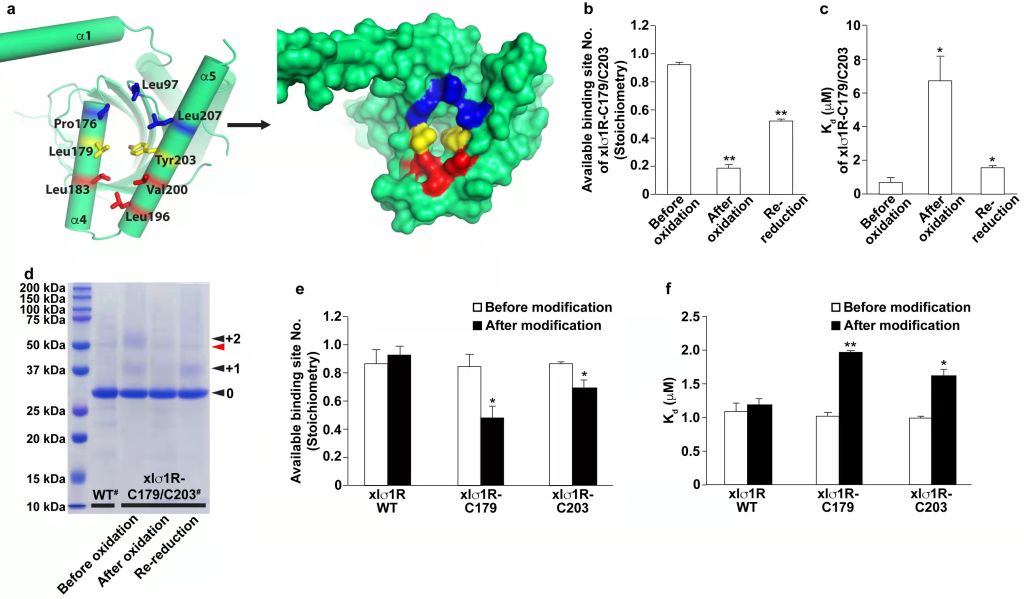
图3 xlσ1R入口突变及配体结合实验。选自原文Figure 4
综上所述,该研究通过X-射线晶体衍射技术解析了非洲爪蟾σ1R开放性结构,支持σ1R配体通过α4和α5螺旋之间的开口(PATH2途径)进入受体β-桶内的配体结合位点。ITC测定了此开口正常和受限状态下受体与配体间结合参数的变化,进一步验证了文章论点。该研究结果对靶向调控σ1R功能来治疗多种疾病具有重要指导意义
【免责申明】本专题图片均来源于学校官网或互联网,若有侵权请联系400-0815-589删除。