药学院王建伟团队在造血干细胞功能调控研究方向取得新进展
造血干细胞(hematopoietic stem cell, HSC)是血液系统的干细胞,不仅能够自我更新以保持干细胞池的完整性,而且能够向下游分化为所有血液细胞。这些不同种类的血液细胞发挥着多种多样的功能,比如白细胞对抗感染,红细胞携带氧气到组织,血小板有助于阻止出血。然而,成熟血液细胞是短暂存活的,需要不断地补充更新。在人体内,血液细胞的更新速度接近每天1012个细胞,而这些新生血液细胞的产生依赖于造血干细胞。因此,更好地解析造血干细胞的调控机制具有重要的科学意义。
近日,清华大学药学院王建伟团队在《血液学》(Haematologica)上发表了题为“YTHDF3通过识别Ccnd1 mRNA上的m6A修饰调控造血干细胞的功能”(YTHDF3 modulates hematopoietic stem cells by recognizing RNA m6A modification on Ccnd1)的文章,该文章解析了METTL3→YTHDF3→ CCND1信号通路调控造血干细胞功能的分子机制。该研究有助于研究者更加深入了解造血干细胞的调控机制,同时也为改善造血干细胞的功能提供一种新的途径。
RNAm6A甲基化修饰是在RNA分子上的一种表观遗传修饰,具体是指RNA的腺嘌呤(A)的第6位N通过甲基转移酶催化形成的一种甲基化修饰。前期研究发现RNAm6A在基因表达调控,动物发育和人类疾病中发挥重要作用。在血液系统发育过程中,研究者们也发现,RNAm6A甲基转移酶Mettl3的缺失导致斑马鱼或小鼠胚胎中造血干细胞不能正常产生,内皮-造血转化过程受到阻滞。同时,在成体小鼠造血干细胞中条件性敲除Mettl3导致造血干细胞重建功能降低,数目增多,但其机制仍不是很清楚。因此,探究RNAm6A甲基化对造血干细胞功能影响的机制对于维持血液和免疫系统的稳态具有重要的作用。
王建伟团队长期致力于造血干细胞衰老相关的研究工作,近年来探究出炎症因子TNFα通过ERK→ETS1→IL27Ra信号通路导致造血干细胞衰老的分子机制,以及解析了衰老进程中DNMT3A hR882H/mR878H突变导致造血干细胞克隆性增生的分子生物学机制,并筛选能够选择性的抑制携带DNMT3A R882突变导致造血干细胞的克隆性增生的小分子药物——冬凌草甲素。
研究人员系统性地构建了RNA m6A通过其甲基转移酶METTL3、RNA m6A识别蛋白YTHDF1和YTHDF3敲除小鼠,并进行造血干细胞移植实验。结果显示,敲除METTL3和YTHDF3均导致造血干细胞的重建能力降低(图1)。
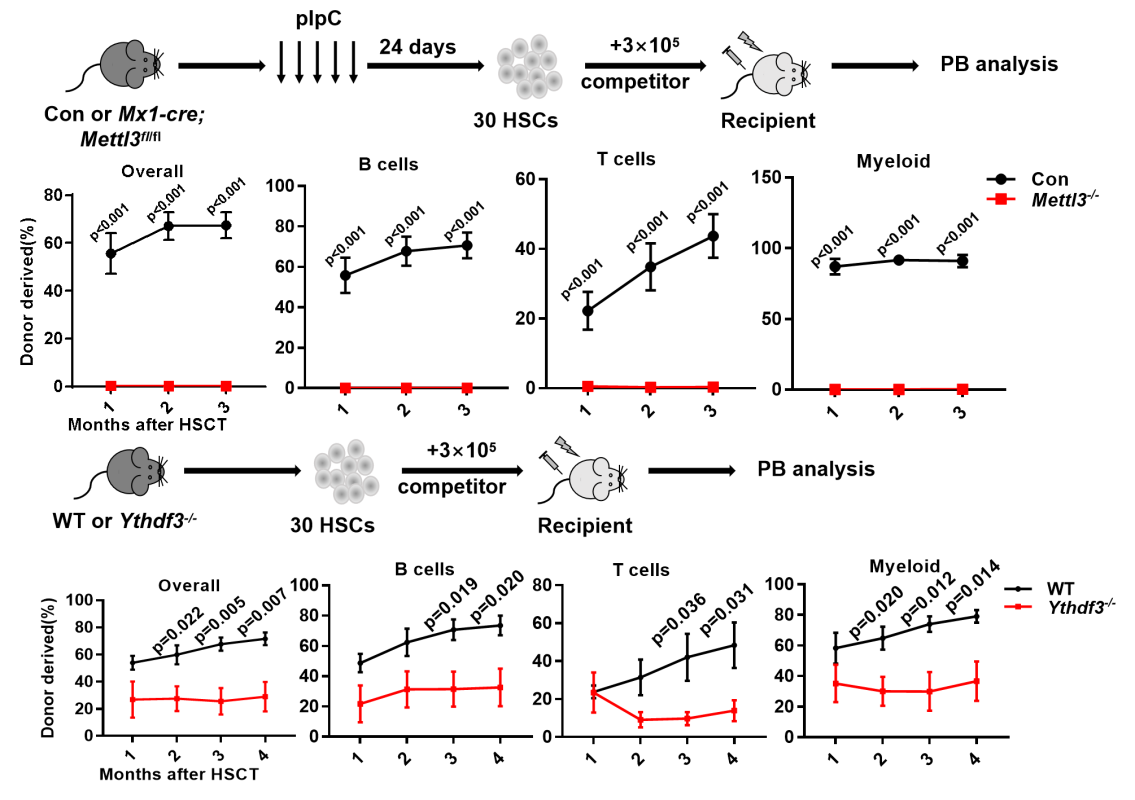
图1 METTL3和YTHDF3敲除小鼠造血干细胞移植示意图
基于以上移植结果,该研究进行了一系列的分子机制探究。首次揭示出METTL3→RNA m6A→YTHDF3→CCND1信号通路调控造血干细胞重建功能的分子机制(图2)。同时本研究也为探索RNA m6A等RNA修饰调控造血干细胞等体细胞干细胞的功能机制提供了重要参考。
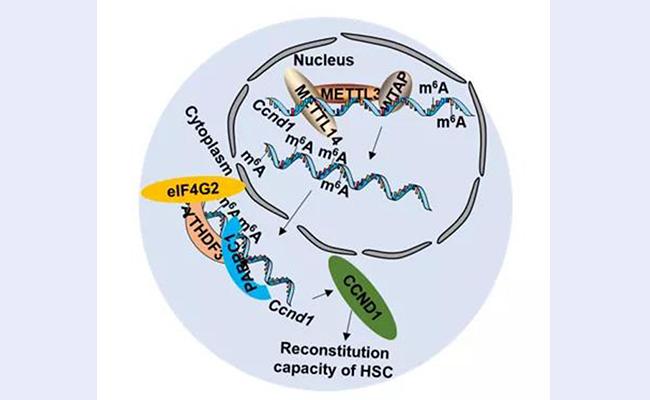
图2 METTL3→ RNA m6A→ YTHDF3 →CCND1信号通路调控HSC重建功能模式图
王建伟实验室2017级博士生张潇飞和2019级博士生丛婷婷为该论文的共同第一作者,王建伟研究员、浙江大学第一附属医院的姜虹博士和北京解放军总医院朱平教授为共同通讯作者。本项目受到了国家自然科学基金、国家重点研发计划、北京市科委项目及清华大学-北京大学生命科学联合中心的资助。
【免责申明】本专题图片均来源于学校官网或互联网,若有侵权请联系400-0815-589删除。