华西医院邵振华-颜微团队联合苏昭铭团队揭示脂质受体S1PR1和S1PR5识别药物的药理学机制
1-磷酸鞘氨醇 (S1P) 是细胞膜鞘脂的代谢产物,是一种无处不在的溶血磷脂信号分子,S1P通过与五种亚型S1P受体(S1PR1–S1PR5,属于G蛋白偶联受体GPCR家族)结合来调节多种生物功能,包括淋巴细胞运输、血管发育、内皮完整性和心率。S1P-S1PRs 信号通路是多种疾病的有效治疗靶点,包括自身免疫性疾病、炎症、癌症甚至 COVID-19。目前,已有四款S1PRs调节剂获批上市,适应症主要集中于自身免疫系统疾病包括多发性硬化症(MS)和溃疡性结肠炎。
由于五种亚型的S1PRs序列高度同源,药物容易产生脱靶效应引起副作用。例如,第一代药物芬戈莫德是S1PR1和S1PR5的双重受体调节剂,受体选择性低,且由于激动S1PR3,从而引起心动过缓、房室传导阻滞等临床不良反应。寻找高活性和高选择性的新药物是人们一直追求的目标。因此,了解S1PRs的药物识别模式和信号转导机制对于靶向药物的研发至关重要。

近日,四川大学华西医院邵振华-颜微研究团队,联合苏昭铭教授团队,共同在Cell Research杂志在线发表了他们最新的研究成果“Structures of signaling complexes of lipid receptors S1PR1 and S1PR5 reveal mechanisms of activation and drug recognition”,在人体脂质受体信号转导研究领域取得重大进展。该研究成功解析了1-磷酸鞘氨醇 (S1P)受体S1PR1及S1PR5与多种药物及下游信号转导分子Gi蛋白三元复合物的冷冻电镜结构(图1),结合药理学实验手段揭示了S1PR受体的激活机理及配体选择性机制。
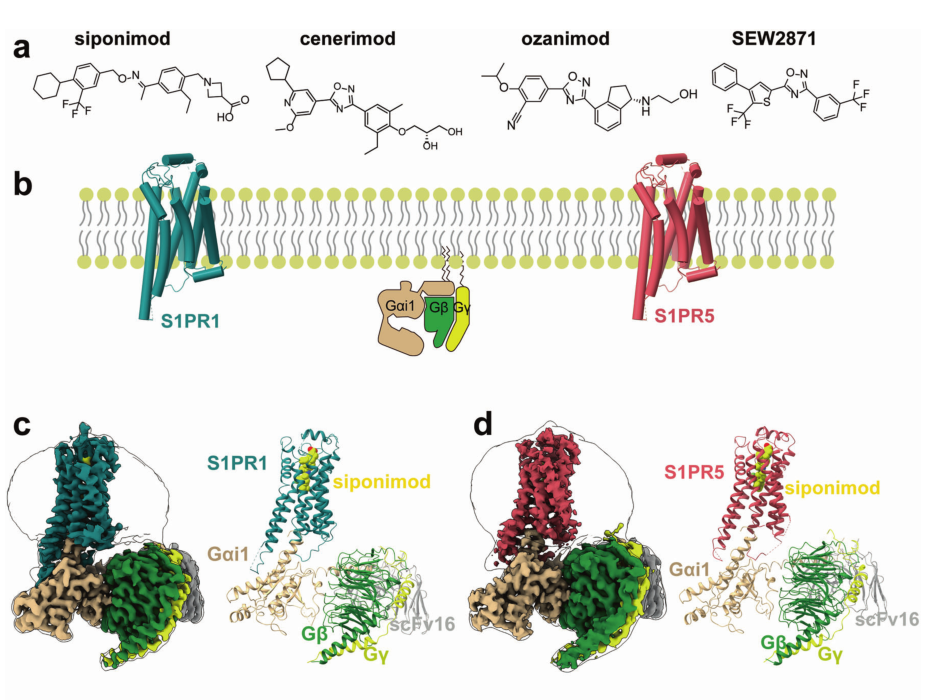
图1. S1PR1/S1PR5-Gi与不同配体的冷冻电镜三维结构
结果显示,S1PR1和S1PR5含有一个非常保守的配体结合口袋,由一个极性模块和一个疏水空腔组成。作者通过突变S1PR1和S1PR5受体中的残基并进行信号转导分析,探讨了S1PR1和S1PR5中配体选择性的可能性原因。此外,通过比较非激活态和激活态的S1PR1,作者发现药物激活受体的“双触发开关”机制,与大麻素受体CB1激活过程有“异曲同工”之处。更重要的是,S1PRs的细胞内环区域ICL2对下游效应G蛋白的选择性有决定性作用。该项研究将为多发性硬化症、系统性红斑狼疮、恶性肿瘤、新冠肺炎等疾病的药物开发和治疗提供新思路。
四川大学华西医院为本课题第一完成单位和第一通讯单位,硕士毕业生袁媛、科研助理贾国文、博士研究生吴超以及硕士毕业生汪微为本文共同第一作者;邵振华研究员、苏昭铭研究员和颜微副研究员为共同通讯作者。本研究得到了四川大学华西冷冻电镜平台、及南方科技大学冷冻电镜中心的支持以及国家科技部、国家自然基金委和四川大学华西医院等资助。
【免责申明】本专题图片均来源于学校官网或互联网,若有侵权请联系400-0815-589删除。